Đề kiểm tra giữa học kỳ I môn Hóa học Lớp 9 - Năm học 2020-2021 - Trường THCS Trần Quốc Toản
Phần I: Trắc nghiệm (4,0 điểm).
Hãy chọn một trong những chữ cái A, B, C, D đứng trước câu trả lời đúng.
Câu 1: Trong các oxit sau, oxit không tan trong nước là
A. MgO. B. P2O5. C . Na2O. D. CO2.
Câu 2: Oxit tác dụng được với dung dịch HCl là
A.SO2. B. CO2. C. CuO. D. P2O5.
Câu 3: Nhóm chỉ gồm các oxit axit là:
A. CO2, P2O5, MgO, SO2. B. CO2, P2O5, NO, SO2.
C. CO, P2O5, MgO, SO2. D. CO2, P2O5, SO3, SO2.
Câu 4: Để pha loãng H2SO4 đặc an toàn, cần
A. cho từ từ H2SO4 đặc vào bình đựng nước.
B. cho từ từ nước vào bình đựng H2SO4 đặc.
C. rót đồng thời H2SO4 đặc và nước vào bình.
D. cách A và B đều dùng được.
Câu 5: Cho các dung dịch sau: NaCl, NaOH, HCl, H2SO4, KNO3. Trong các dung dịch trên, có bao nhiêu dung dịch có pH <>
A. 2. B. 3. C. 4. D. 5.
Câu 6: Nhỏ từ từ cho đến dư dung dịch NaOH vào một ống nghiệm có chứa 1 ml dung dịch FeCl3. Lắc nhẹ ống nghiệm. Hiện tượng nào xảy ra?
A. Có kết tủa màu xanh. B. Có kết tủa màu nâu đỏ.
C. Có kết tủa, sau đó tan đi. D. Có kết tủa màu trắng.
Câu 7: Chất nào sau đây tác dụng với dung dịch Ba(OH)2?
A. CO2. B. Na2O. C. CO. D. MgO.
Câu 8: Phản ứng được sử dụng để điều chế NaOH trong công nghiệp là
A. 2Na + 2H2O 2NaOH + H2. B. Na2CO3 + Ba(OH)2 BaCO3 + 2NaOH.
C. Na2O + H2O 2NaOH. D. 2NaCl + 2H2O đpdd 2NaOH + H2 + Cl2.
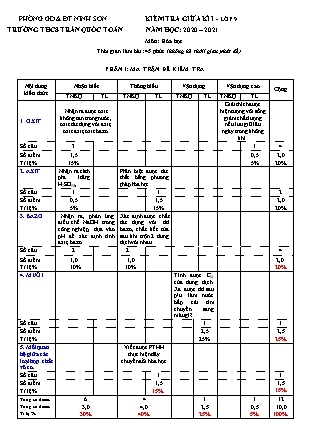
PHÒNG GD & ĐT NINH SƠN KIỂM TRA GIỮA KÌ I - LỚP 9 TRƯỜNG THCS TRẦN QUỐC TOẢN NĂM HỌC: 2020 – 2021 Môn: Hóa học Thời gian làm bài: 45 phút (không kể thờii gian phát đề) PHẦN I: MA TRẬN ĐỀ KIỂM TRA Nội dung kiến thức Nhận biết Thông hiểu Vận dụng Vận dụng cao Cộng TNKQ TL TNKQ TL TNKQ TL TNKQ TL 1. OXIT Nhận ra được oxit không tan trong nước, oxit tác dụng với axit, oxit axit, oxit bazơ. Giải thích được hiện tượng vôi sống giảm chất lượng nếu lưu giữ lâu ngày trong không khí. Số câu 3 1 4 Số điểm. Tỉ lệ % 1,5 15% 0,5 5% 2,0 20% 2. AXIT Nhận ra cách pha loãng H2SO4đ, Phân biệt được các chất bằng phương pháp hóa học. Số câu 1 1 2 Số điểm. Tỉ lệ % 0,5 5% 1,5 15% 2,0 20% 3. BAZƠ Nhận ra, phản ứng điều chế NaOH trong công nghiệp, dựa vào pH để xác định tính axit, bazơ. Xác định được chất tác dụng với dd bazơ, chất kết tủa sau khi trộn 2 dung dịch với nhau. Số câu 2 2 4 Số điểm. Tỉ lệ % 1,0 10% 1,0 10% 2,0 20% 4. MUỐI Tính được CM của dung dịch. Xđ được dd sau p/ư làm nước bắp cải tím chuyển sang màu gì?. Số câu 1 1 Số điểm. Tỉ lệ % 2,5 25% 2,5 25% 5. Mối quan hệ giữa các loại hợp chất vô cơ. Viết được PTHH thực hiện dãy chuyển đổi hóa học. Số câu. 1 1 Số điểm. Tỉ lệ % 1,5 15% 1,5 15% Tổng số điểm. Tổng số điểm. Tỉ lệ % 6 3,0 30% 4 4,0 40% 1 2,5 25% 1 0,5 5% 12 10,0 100% PHÒNG GD & ĐT NINH SƠN Tiết 21: KIỂM TRA GIỮA KÌ I TRƯỜNG THCS TRẦN QUỐC TOẢN NĂM HỌC: 2020 – 2021 Môn: Hóa học. Lớp 9 Đề 1: Thời gian làm bài: 45 phút (không kể thờii gian phát đề) Họ và tên: ............................... ................................................. Lớp: 9 Điểm: Lời nhận xét của GV: Phần I: Trắc nghiệm (4,0 điểm). Hãy chọn một trong những chữ cái A, B, C, D đứng trước câu trả lời đúng. Câu 1: Trong các oxit sau, oxit không tan trong nước là A. MgO. B. P2O5. C . Na2O. D. CO2. Câu 2: Oxit tác dụng được với dung dịch HCl là A.SO2. B. CO2. C. CuO. D. P2O5. Câu 3: Nhóm chỉ gồm các oxit axit là: A. CO2, P2O5, MgO, SO2. B. CO2, P2O5, NO, SO2. C. CO, P2O5, MgO, SO2. D. CO2, P2O5, SO3, SO2. Câu 4: Để pha loãng H2SO4 đặc an toàn, cần A. cho từ từ H2SO4 đặc vào bình đựng nước. B. cho từ từ nước vào bình đựng H2SO4 đặc. C. rót đồng thời H2SO4 đặc và nước vào bình. D. cách A và B đều dùng được. Câu 5: Cho các dung dịch sau: NaCl, NaOH, HCl, H2SO4, KNO3. Trong các dung dịch trên, có bao nhiêu dung dịch có pH < 7? A. 2. B. 3. C. 4. D. 5. Câu 6: Nhỏ từ từ cho đến dư dung dịch NaOH vào một ống nghiệm có chứa 1 ml dung dịch FeCl3. Lắc nhẹ ống nghiệm. Hiện tượng nào xảy ra? A. Có kết tủa màu xanh. B. Có kết tủa màu nâu đỏ. C. Có kết tủa, sau đó tan đi. D. Có kết tủa màu trắng. Câu 7: Chất nào sau đây tác dụng với dung dịch Ba(OH)2? A. CO2. B. Na2O. C. CO. D. MgO. Câu 8: Phản ứng được sử dụng để điều chế NaOH trong công nghiệp là A. 2Na + 2H2O à2NaOH + H2. B. Na2CO3 + Ba(OH)2 à BaCO3 + 2NaOH. C. Na2O + H2O à2NaOH. D. 2NaCl + 2H2O đpdd 2NaOH + H2 + Cl2. có màn ngăn Phần II: Tự luận (6,0 điểm). Câu 1: (0,5 điểm) Vì sao vôi sống sẽ giảm chất lượng nếu lưu giữ lâu ngày trong tự nhiên? Câu 2: (1,5 điểm) Bằng phương pháp hóa học hãy nhận biết các dung dịch sau: NaCl, HCl, Na2SO4. Câu 3: (1,5 điểm) Hoàn thành dãy chuyển hóa sau (ghi rõ điều kiện phản ứng nếu có) FeSO4 (1) FeCl2 (2) Fe(OH)2 (3) FeO Câu 4: (2,5 điểm) Cho một hỗn hợp 2 muối khan MgCl2 và CaCO3 phản ứng vừa đủ với 400ml dung dịch HCl. Sau phản ứng thu được 6,72 lít khí CO2 (đktc). a. Viết PTHH xảy ra. b. Tính nồng độ mol của dung dịch axit đã dùng. c. Nếu dùng 80 ml dung dịch axit HCl trên trung hòa với 80ml NaOH 2M thì dung dịch sau phản ứng làm nước bắp cải tím chuyển sang màu gì? (Biết: Ca = 40, C =12, O =16) Bài làm: PHẦN III: ĐÁP ÁN, HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM BIỂU ĐIỂM Phần I: HS chọn đúng mỗi câu 0,5 điểm Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 Câu 7 Câu 8 A C D A A B A D 4,0đ Phần II: Câu 1.Vì vôi sống sẽ hấp thụ khí cacbon đioxit có trong không khí tạo thành canxi cacbonat 0,5đ Câu 2. Dùng quỳ tím nhận ra dung dịch HCl (quỳ tím hóa đỏ), quỳ tím không đổi màu là NaCl và Na2SO4. Dùng dung dịch BaCl2 để nhận ra dung dịch Na2SO4 (có kết tủa trắng). Dung dịch không phản ứng là NaCl. Na2SO4 + BaCl2 BaSO4 + 2NaCl 0,5đ 0,5đ 0,5đ Câu 3. (1): FeSO4 + BaCl2→ BaSO4 ↓ + FeCl2 (2): FeCl2 + 2NaOH → 2NaCl + Fe(OH)2 t0 (3): Fe(OH)2 t0 FeO + H2O 0,5đ 0,5đ 0,5đ Câu 4. a/ CaCO3 + 2HCl → CaCl2 + H2O + CO2 0,5đ b/ n CO2 = 6,72 : 22,4 = 0,3mol CaCO3 + 2HCl → CaCl2 + H2O + CO2 0,3mol 0,6mol 0,3mol CM HCl = 0,6: 0,4 = 1,5 M 0,25đ 0,25đ 0,25đ c/ HCl + NaOH NaCl + 2H2O 1mol 1mol 0,12 0,16 Số mol của HCl: n = CM . V = 80/1000 x 1,5 = 0,12 (mol) Số mol của NaOH: n = CM . V = 80/1000 x 2 = 0, 16 (mol) Tỉ lệ: 0,12/1 < 0,16/1 Vậy sau phản ứng NaOH dư nên dung dịch làm quì tím hóa xanh. 0,25đ 0,25đ 0,25đ 0,5đ
Tài liệu đính kèm:
 de_kiem_tra_giua_hoc_ky_i_mon_hoa_hoc_lop_9_nam_hoc_2020_202.doc
de_kiem_tra_giua_hoc_ky_i_mon_hoa_hoc_lop_9_nam_hoc_2020_202.doc



