Bài giảng Hóa học Lớp 9 - Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
II. Cấu tạo bảng tuần hoàn.
1. Ô nguyên tố
2. Chu kì
- Chu kỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
- Sè thø tù cña chu kì b»ng sè líp electron.
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 9 - Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
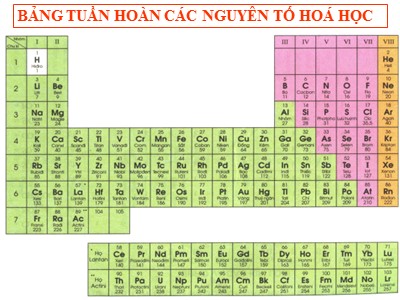
BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn Đ. I. Men – đê – lê – ép (1834 – 1907) Năm 1869, nh à b á c học Nga Đ. I. Men-đ ê -l ê - e p đ ã sắp xếp khoảng 60 nguy ê n tố trong bảng tuần h oàn theo chiều tăng dần của nguy ê n tử khối * Cho đến nay, bảng tuần hoàn c ó bao nhi ê u nguy ê n tố? * C á c nguy ê n tố được sắp xếp theo nguy ê n tắc n à o? BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC NHÓM CHU KÌ SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn II. Cấu tạo bảng tuần hoàn - Ô nguyên tố - Chu kì - Nhóm Tiết 39. Bài 31 : SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn II. Cấu tạo bảng tuần hoàn 1. Ô nguyên tố Tiết 39. Bài 31 : Số hiệu nguyên tử Kí hiệu hóa học Tên nguyên tố Nguyên tử khối Số hiệu nguyên tử Tên nguyên tố Kí hiệu hóa học Nguyên tử khối SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn II. Cấu tạo bảng tuần hoàn. 1. Ô nguyên tố Số hiệu nguyên tử có trị số bằng: Số đơn vị điện tích hạt nhân Số hiệu nguyên tử trùng với số thứ tự của nguyên tố trong bảng tuần hoàn Tiết 39. Bài 31 : Bµi tËp 1 : XÐt nguyªn tè ë « thø 35 trong b¶ng tuÇn hoµn. Đ iÒn sè thÝch hîp vµo b¶ng sau: Tªn nguyªn tè KÝ hiÖu Nguyªn tö khèi ĐiÖn tÝch h¹t nh©n Sè p Brom Br 80 35+ 35 BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC CHU KÌ 4 SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn II. Cấu tạo bảng tuần hoàn. 1. Ô nguyên tố 2. Chu kì Tiết 39. Bài 31 : SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn II. Cấu tạo bảng tuần hoàn. Ô nguyên tố Chu kì Bảng tuần hoàn gồm 7 chu kì 1,2,3 được gọi là chu kì nhỏ 4,5,6,7 được gọi là chu kì lớn (chu kì 7 chưa hoàn chỉnh) Tiết 39. Bài 31 : Chu kỳ 1 Chu kỳ 1 1 H Hiđro 2 He Heli Cấu tạo nguyên tử Số lớp e 1+ 2+ 1 1 Chu kì 1 : - Gåm 2 nguyªn tè ( H, He) - Được sắp xếp theo chiều tăng dần của điện tích hạt nhân - Cã 1 líp e trong nguyªn tö(Sè thø tù cña chu kú =sè líp e) Chu kỳ 2 Chu kỳ 2 3 Li Liti 4 Be Beri 5 B Bo 6 C Cacbon 7 N Nitơ 8 O Oxi 9 F Flo 10 Ne Neon Cấu tạo Số lớp e 3+ 4+ 5+ 6+ 7+ 8+ 9+ 10+ 2 2 2 2 2 2 2 2 Chu kì 2 : - Gồm 8 nguyên tố( Từ Li Ne ) - Được sắp xếp theo chiều tăng dần của điện tích hạt nhân - Có 2 lớp e trong nguyên tử(Số thứ tự của chu kỳ =số lớp e) Chu kỳ 3 Chu kì 3 11 Na Natri 12 Mg Magie 13 Al Nh«m 14 Si Silic 15 P Photpho 16 S Lu huúnh 17 Cl Clo 18 Ar Agon CÊu t¹o Sè líp e 11+ 12+ 13+ 14+ 15+ 16+ 17+ 18+ 3 3 3 3 3 3 3 3 Chu kì 3 : - Gåm 8 nguyªn tè ( Tõ Na Ar ) - Được sắp xếp theo chiều tăng dần của điện tích hạt nhân - Cã 3 líp e trong nguyªn tö(Sè thø tù cña chu kú =sè líp e) SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn II. Cấu tạo bảng tuần hoàn. 1. Ô nguyên tố 2. Chu kì Tiết 39. Bài 31 : - Chu k ỳ là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần. - Sè thø tù cña chu kì b»ng sè líp electron. SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn II. Cấu tạo bảng tuần hoàn. Ô nguyên tố Chu kì 3. Nhóm Tiết 39. Bài 31 : Nhãm I : 3+ 11+ 19+ 37+ 87+ 55+ Nhóm I Số e lớp ngoài cùng Điện tích hạt nhân Li Na K Rb Cs Fr 1 1 1 1 1 1 19+ 3+ 11+ 55+ 37+ 87+ - Nhãm I : + Gåm c¸c nguyªn tè kim lo¹i ho¹t ®éng m¹nh + Đ ề u cã 1 electron líp ngoµi cïng. + ĐiÖn tÝch h¹t nh©n t ă ng tõ Li(3+) ®Õn Fr(87+) Nhóm VII Số e lớp ngoài cùng Điện tích hạt nhân F Cl Br I At 7 7 7 7 7 35+ 9+ 17+ 85+ 53+ Nhóm VII: 9 F Flo 17 Cl Clo 85 At Atatin 35 Br Brom 53 I Iot VII 9+ 17+ 35+ 53+ 85+ - Nhãm VII : + Gåm c¸c nguyªn tè phi kim ho¹t ®éng m¹nh + ĐÒu cã 7 electron líp ngoµi cïng. + ĐiÖn tÝch h¹t nh©n t ă ng tõ F(9+) ®Õn At(85+) SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. II. Cấu tạo bảng tuần hoàn. Ô nguyên tố Chu kì 3 . Nhóm Tiết 39. Bài 31 : Sè thø tù cña nhãm b»ng sè electron líp ngoµi cïng. - Nhóm gồm các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau và do đó chúng có tính chất tương tự nhau, được sắp xếp thành cột, theo chiều tăng của điện tích hạt nhân. Bµi tËp 2 : Quan s¸t b¶ng tuÇn hoµn, ®iÒn sè liÖu thÝch hîp vµo b¶ng sau: Tªn nguyªn tè KÝ hiÖu ho¸ häc Sè hiÖu nguyªn tö ĐiÖn tÝch h¹t nh©n 8 19+ Oxi O 8+ Ca Canxi 20 20+ Kali K 19 Bµi tËp 3 : Nguyªn tè A cã cÊu t¹o nguyªn tö nh sau: Đ iÖn tÝch h¹t nh©n 15+, cã 3 líp e vµ 5 e líp ngoµi cïng. H·y x¸c ®Þnh vÞ trÝ cña A trong b¶ng tuÇn hoµn,tªn, kÝ hiÖu cña A. Lêi gi¶i: - A cã ®iÖn tÝch h¹t nh©n lµ 15+ => A ë « 15 - A cã 3 líp e => A ë chu kì 3 - A cã 5 e líp ngoµi cïng => A ë nhãm V VËy A lµ Photpho kÝ hiÖu lµ P Hướng dẫn học tập * Đối với bài học ở tiết này - Học bài, làm bài tập 1,3/SGK/101 * Đối với bài học ở tiết sau - Xem bài 31:” Sơ lược về bảng tuần hoàn các nguyên tố hóa học” phần III và IV + Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn + Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
Tài liệu đính kèm:
 bai_giang_hoa_hoc_lop_9_bai_31_so_luoc_ve_bang_tuan_hoan_cac.ppt
bai_giang_hoa_hoc_lop_9_bai_31_so_luoc_ve_bang_tuan_hoan_cac.ppt



