Bài giảng Hóa học Lớp 9 - Tiết 39+40: Sơ lược về bảng hệ thống tuần hoàn các nguyên tố hóa học
Nguyên tắc sắp xếp các nguyên tố trong bảng HTTH:
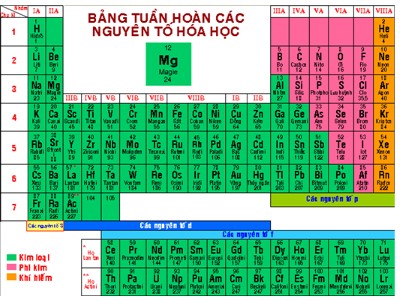
Cấu tạo của bảng HTTH:
Biến đổi tính chất:
Ý nghĩa bảng HTTH
Vị trí của một nguyên tố trong bảng tuần hoàn
Số thứ tự của nguyên tố
- Số thứ tự của chu kì
- Số thứ tự của nhóm A
Cấu tạo nguyên tử
Số proton, số electron
- Số lớp electron
- Số electron lớp ngoài cùng
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 9 - Tiết 39+40: Sơ lược về bảng hệ thống tuần hoàn các nguyên tố hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
Tiết 39+ 40: SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCTiết 39+40: SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCMen-đê-lê-ép 1834 - 1907Bảng HTHH các nguyên tố hóa học có tuổi thọ trên 150 năm. Năm 1869, Men-đê-lê-ép đã tìm ra được định luật tuần hoàn và công bố bảng tuần hoàn các nguyên tố hóa học. Ở thời kì của ông, chỉ có 63 nguyên tố được tìm thấy, nên ông phải để trống một số ô trong bảng và dự đoán các tính chất của các nguyên tố này trong các ô đó. Sau này các nguyên tố đó đã được tìm thấy với các tính chất đúng với các dự đoán của ông. Tiết 39+ 40: SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:CỘTHÀNGTiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:TÊN NGUYÊN TỐKÍ HIỆUNGUYÊN TỬ KHỐISÓ HIỆU NGYÊN TỬTiết 39+ 40 0: SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Tên nguyên tốSố ttSố hiệu ngyên tửĐiện tích hạt nhânSố protonSố ElectronNatri (Na)111111+1111Magie (Mg)121212+1212Liti (Li)333+33 => Số hiệu nguyên tử = STT => Điện tích hạt nhân => Số p trong hạt nhân => Số electron ngoài vỏTên nguyên tốKí hiệuSố hiệu ngyên tửĐiện tích hạt nhânSố protonSố Electron5+2019+Tên nguyên tốKí hiệuSố hiệu ngyên tửĐiện tích hạt nhânSố protonSố ElectronBoB55+55CanxiCa2020+2020KaliK1919+1919Tiết 39+ 40: SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:Hàng (chu kì):Chu kì 11HHidro2HeHeliCấu tạo nguyên tử Số lớp Electron111+2+Tiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:Hàng (chu kì):Chu kì23LiLiti4BeBeri5BBo6CCacbon7NNitơ8OOxi9FFlo10NeNeonCấu tạoSố lớp e3+4+5+6+7+8+9+10+2 2 2 2 2 2 2 2 Chu kì311NaNatri12MgMagie13AlNhôm14SiSilic15PPhotpho16SLưu huỳnh17ClClo18ArAgonCấu tạoSố lớp e11+12+14+13+15+16+17+18+3 3 3 3 3 3 3 3 Tiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:Hàng (chu kì):3+11+19+37+87+55+Nhóm ISố lớp e ngoài cùngSố điện tích hạt nhânLiNaKRbCsFr11111119+3+11+55+37+87+Tiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:Chu kì (hang ngang):Nhóm (cột):Nhóm VIISố lớp e ngoài cùngSố điện tích hạt nhânFClBrIAt7777735+9+17+85+53+9FFlo17ClClo85AtAtatin35BrBrom53IIotVII9+17+35+53+85+Tiết 39+ 40 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:Chu kì (hang ngang):Nhóm (cột):- B¶ng tuÇn hoµn c¸c nguyªn tè gåm 8 nhãm. - Nhãm gåm c¸c nguyªn tè mµ nguyªn tö cña chóng cã sè electron líp ngoµi cïng .................... vµ do ®ã cã ............... t¬ng tù nhau ®îc xÕp thµnh cét theo chiÒu t¨ng cña..................................nguyªn tö. - Sè thø tù cña nhãm b»ng ................. líp ngoµi cïng cña nguyªn tö. b»ng nhautÝnh chÊt®iÖn tÝch h¹t nh©nsè electronTên nguyên tốKí hiệu hóa họcSố hiệu nguyên tửSố điện tích hạt nhânSố PSố eSố lớp eSố e lớp ngoài cùngBoB55+552CanxiCa2020+20204KaliK1919+19194321Tiết 39+ 40: SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:Chu kì (hang ngang):Nhóm (cột):Tiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Ô:Chu kì (hang ngang):Nhóm (cột):III. Bài tập:sttTên Kí hiệuNTKĐiện tích hạt nhânSố pSố e35 Cấu tạo nguyên tử của nguyên tố SUY RAVị trí của nguyên tốtrong bảng HTTHĐiện tích hạt nhân15+STT15Lớp e3CHU KÌ3Số e lớp ngoài5NHÓMVBài 1: Xác định tên nguyên tố có stt 35 trong bảng HTTH bằng cách hoàn thiện bảng sau:Bài 2: Cho biết cấu tạo nguyên tố sau: Điện tích hạt nhân 15+; có 3 lớp e; Có 5 e lớp ngoài cùng. Hãy xác định vị trí của nguyên tố đó trong bảng HTTH và cho biết tên nguyên tố.Lời giải:23LiLiti74BeBeri95BBo116CCacbon127NNitơ148OOxi1610NeNeon209FFlo19nhóm Inhóm IInhóm IIInhómIV nhóm Vnhóm VInhómVII nhóm VIII311NaNatri2312MgMagie2413AlNh«m2714SiSilic2815PPhotpho3116SLưu huỳnh3218ArAgon4017ClClo35,5nhóm Inhóm IInhóm IIInhómIV nhóm Vnhóm VInhómVII nhóm VIIIĐầu chu kìTính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dầnTiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCIII. Sư biến đổi tính chất trong bảng HTTH:1. Trong một chu kì:Cuối chu kìĐầu chu kìCuối chu kìKết thúc chu kìKim lo¹i M¹nhPhi Kim M¹nhKhÝ hiÕm3LiLiti711NaNatri2323LiLiti74BeBeri95BBo116CCacbon127NNitơ148OOxi1610NeNeon209FFlo19nhóm Inhóm IInhóm IIInhómIV nhóm Vnhóm VInhómVII nhóm VIII311NaNatri2312MgMagie2413AlNh«m2714SiSilic2815PPhotpho3116SLưu.huúnh3218ArAgon4017ClClo35,59FFlo1917ClClo35,510NeNeon2018ArAgon40Tiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCIII. Sư biến đổi tính chất trong bảng HTTH:1. Trong một chu kì:Bài tập:Hãy sắp xếp các nguyên tố dau theo trình tự :a. Tính kim loại giảm dần : Ca, K, Fb. Tính phi kim tăng dần : O, C, FI3LiLiti711NaNatri2319KKali3937RbRubiđi8587FrFranxi22355CsXesi132Chu kì 2Chu kì 3Chu kì 4Chu kì 5Chu kì 7Chu kì 6VII9FFlo1917ClClo35,535BrBrom8053IIot12785AtAtatin210Chu kì 2Chu kì 3Chu kì 4Chu kì 5Chu kì 6Đầu nhómCuối nhómTính kim loại của các nguyên tố tăng dần từ Li đến Fr,đồng thời tính phi kim của các nguyên tố giảm dần từ F đến IKim loại mạnhKim loại rất mạnhPhi kim rất mạnhPhi kim yếu hơnIII. Sư biến đổi tính chất trong bảng HTTH:2. Trong một nhóm:Bài tập:Hãy sắp xếp các nguyên tố theo trình tự :a. Tính kim loại tang dần : Mg, Ba, Cab. Tính phi kim giảm dần : Se, O, SBài tập 1: Hãy cho biết cách sắp xếp nào sau đây đúng theo chiều tính phi kim tăng dần?a. F, As, P, N, O c. As, O, P, N, Fb. As, P, N, O, F d. N, O, As, P, F Bài tập 2: Hãy cho biết cách sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần?a. Na, Mg, Al, K c. Na, Al, K, Mg b. K, Na, Mg, Al d. Na, Mg, K, Al Bài tâp 3: Hãy hoàn thành nội dung còn thiếu ở bảng dưới đâyTTKí hiệuVị trí bảng tuần hoànCấu tạo nguyên tửTính chất hoá học cơ bảnTTChu kìNhómSố pSố e1Na113I2Br353Mg 124O85N7TTKí HiệuVị trí bảng tuần hoànCấu tạo nguyên tửTính chất hoá học cơ bảnTTChu kìNhómSố pSố e1Na113I2Br353Mg123II4O85N72V77 Phi kimĐáp án:1111Kim loại354VII35Phi kim121282VI8Kim loạiPhi kimCâu 4: Nguyên tố X có số thứ tự là 11 thuộc chu kì 3, nhóm IA. Số electron của nguyên tử nguyên tố X là?A. 11C. 1B. 3D. 14012345ACâu 5: Nguyên tố X có số thứ tự là 11 thuộc chu kì 3, nhóm IA. Số lớp electron của nguyên tử nguyên tố X là?A. 11C. 3B. 2D. 1012345CCâu 3: Nguyên tố X có số thứ tự là 11 thuộc chu kì 3, nhóm IA. Số electron lớp ngoài cùng của nguyên tử nguyên tố X là?A. 3C. 2B. 1D. 4012345BVị trí của một nguyên tố trong bảng tuần hoàn- Số thứ tự của nguyên tố - Số thứ tự của chu kì - Số thứ tự của nhóm A - Số proton, số electron - Số lớp electron - Số electron lớp ngoài cùngCấu tạo nguyên tửTiết 39+ 40 : SƠ LƯỢC VỀ BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌCNguyên tắc sắp xếp các nguyên tố trong bảng HTTH:Cấu tạo của bảng HTTH:Biến đổi tính chất:Ý nghĩa bảng HTTHHướng dẫn làm bài tập a. - Gọi công thức hóa học của A là SxOy-Vì A chứa 50% O nên: = = y = 2x (1)-Mặt khác, A có số mol là: nA = = 0,015625 (mol)MA = = 64 hay 32x +16y = 64 (2)Từ (1) và(2) có x = 1; y =2. Vậy công thức của A là SO2Hướng dẫn bài 7(SGK-T101)Hướng dẫn làm bài tập SO2 + 2NaOH Na2SO3 + H2O (1)SO2 + NaOH NaHSO3 (2)x 2x x (mol)y y y (mol)Ta có hệ x + y = 0,2 x = 0,16 2x + y = 0,36 y = 0,04CM = = 0,53 M ; CM = = 0,13 MNaHCO3Na2CO3Hướng dẫn bài 7(SGK-T101)b. – Ta có: nSO = = 0,2 (mol) = =0,56>0,5nNaOH = 0,3 . 1,2 = 0,36 (mol) 0,5<0,56<1Vậy sản phẩm gồm hỗn hợp 2 muối Na2SO3 và NaHSO32
Tài liệu đính kèm:
 bai_giang_hoa_hoc_lop_9_tiet_3940_so_luoc_ve_bang_he_thong_t.pptx
bai_giang_hoa_hoc_lop_9_tiet_3940_so_luoc_ve_bang_he_thong_t.pptx



