Bài giảng môn Hóa học Lớp 9 - Tiết 14, Bài 9: Tính chất hóa học của muối
II. Phản ứng trao đổi trong dung dịch:
1- Nhận xét về các phản ứng hóa học của muối.
BaCl2 + Na2SO4 BaSO4 + 2NaCl
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
Na2CO3 + H2SO4 Na2SO4 + H2O + CO2 ↑
2- Phản ứng trao đổi:
Là phản ứng hóa học trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.
3- Điều kiện xảy ra phản ứng trao đổi: Sản phẩm tạo thành có chất không tan hoặc chất khí.
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng môn Hóa học Lớp 9 - Tiết 14, Bài 9: Tính chất hóa học của muối", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
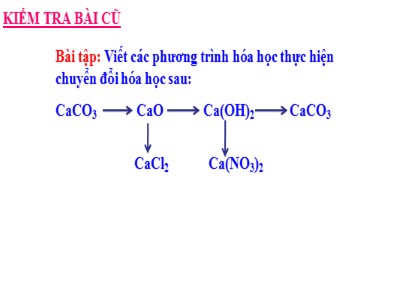
KIỂM TRA BÀI CŨBài tập: Viết các phương trình hóa học thực hiện chuyển đổi hóa học sau:CaCO3 CaO Ca(OH)2 CaCO3 CaCl2 Ca(NO3)2Đáp án (1) CaCO3 CaO +CO2 (2) CaO + H2O Ca(OH)2 (3) Ca(OH)2 + CO2 CaCO3 +H2O (4) CaO + 2HCl CaCl2 + H2O(5) Ca(OH)2 + 2HNO3 Ca(NO3)2 + 2H2OMuối có những tính chất hoá học nào?Phản ứng hoá học xảy ra của muối với các chất gọi là phản ứng gì?BẢNG TÍNH TAN CỦA MỘT SỐ AXIT – BAZƠ – MUỐINhóm hiđroxit và gốc axitHóatrịHIĐRO KIM LOẠIHIKINaIAgIMgIICaIIBaIIZnIIHgIIPbIICuIIFeIIFeIIIAlIIIOH ITT–KITK–KKKKKCl IT/BTTKTTTTTITTTTNO3 IT/BTTTTTTTTTTTTTCH3COO IT/BTTTTTTTTTTT–IS IIT/BTTK–TTKKKKKK–SO3 IIT/BTTKKKKKKKKK––SO4 IIT/KBTTITIT–KTTTTCO3 IIT/BTTKKKKK–KKK––SiO3 IIK/KBTT–KKKK–K–KKKPO4 IIIT/KBTTKKKKKKKKKKKT : hợp chất tan được trong nước K : hợp chất không tan I : hợp chất ít tanB : hợp chất dễ bay hơi/dễ bị phân hủy thành khí bay lênKB : hợp chất không bay hơi“–” : hợp chất không tồn tại hoặc bị phân hủy trong nước .KTI. Tính chất hóa học của muối:1. Muối tác dụng với kim loại:Tiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐIMời các em xem thí nghiệm, quan sát và nêu hiện tượng thí nghiệm sau đây?I. Tính chất hóa học của muối:1. Muối tác dung với kim loại:Tiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐIKL:DD Muối + Kim loại(trừ K,Na,Ca,Ba,Li) Muối mới + Kim loại mớiThí nghiệm: SGKPTHH: 2AgNO3 + Cu Cu(NO3)2 + 2Ag CuSO4 + Fe FeSO4 + Cu Qua thí nghiệm các em rút ra được KL gì?HT:Có chất rắn màu xám bạc bám vào dây đồngI. Tính chất hóa học của muối:2. Muối tác dụng với Axit:Tiết 14 - Bài 9:TÍNH CHẤT HÓA HỌC CỦA MUỐI1. Muối tác dung với Kim loại:Dd Muối + Kim loại(trừ K,Na,Ca,Ba,Li) Muối mới + Kim loại mớiMời các em xem thí nghiệm, quan sát và nêu hiện tượng thí nghiệm sau đây?I. Tính chất hóa học của muối:2. Muối tác dung với axit:Tiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐIKL: DD Muối + DD axit Muối mới + axit mới1. Muối tác dung với kim loại:Dd Muối + Kim loại(trừ K,Na,Ca,Ba,Li) Muối mới + Kim loại mớiPTHH: BaCl2 + H2SO4 BaSO4 + 2HCl Na2CO3 + 2HCl 2NaCl + H2O + CO2 Qua thí nghiệm trên các em rút ra được KL gì?ĐK: Sản phẩm tạo thành có chất không tan hoặc chất dễ bay hơiThí nghiệm: SGKHT:Xuất hiện chất rắn màu trắng không tanTiết 14 - Bài 9:TÍNH CHẤT HÓA HỌC CỦA MUỐII. Tính chất hóa học của muối:3. Muối tác dụng với muối:2. Muối tác dụng với axit:1. Muối tác dụng với Kim loại:Dd Muối + Kim loại(trừ K,Na,Ca,Ba,Li) Muối mới + Kim loại mớiDdMuối + Dd axit Muối mới + Axit mớiMời các em xem thí nghiệm, quan sát và nêu hiện tượng thí nghiệm sau đây?Tiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐII. Tính chất hóa học của muối:3. Muối tác dụng với muối:KL: DD Muối + DD Muối Hai muối mớiĐiều kiện: Sản phẩm tạo thành có chất không tanPTHH: AgNO3 + NaCl AgCl + NaNO3 CuSO4 + BaCl2 BaSO4 + CuCl2 Qua thí nghiệm trên các em rút ra KL gì?Thí nghiệm: SGKHT: Xuất hiện chất rắn màu trắng không tanTiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐII. Tính chất hóa học của muối:4. Muối tác dụng với bazơ:3. Muối tác dụng với muối:2. Muối tác dụng với axit:1. Muối tác dụng với kim loại:KL:Dd Muối + Dd muối Hai muối mớiKL:Dd Muối + Dd Axit Muối mới + Axit mớiKL:DdMuối + Kim loại (trừ K, Na, Ba, Ca, Li) Muối mới + Kim loại mớiMời các em xem thí nghiệm, quan sát và nêu hiện tượng thí nghiệm sau đây?Tiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐII. Tính chất hóa học của muối:4. Muối tác dụng với bazơ:KL:DD Muối + DD Bazơ Muối mới + Bazơ mớiĐiều kiện: Sản phẩm tạo thành có chất không tanPTHH: CuSO4 + 2NaOH Na2SO4 + Cu(OH)2 FeCl3 + 3KOH 3KCl + Fe(OH)3 Qua thí nghiệm trên các em rút ra được KL gì?Thí nghiệm: SGKHT:Xuất hiện chất rắn màu xanh không tanTiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐII. Tính chất hóa học của muối:5. Phản ứng phân hủy muối:4. Muối tác dụng với bazơ:3. Muối tác dụng với muối:2. Muối tác dụng với axit:1. Muối tác dụng với kim loại:Dd Muối + Dd muối Hai muối mớiDd Muối + Dd Axit Muối mới + Axit mớiDd Muối + Dd bazơ Muối mới + bazơ mớiDdMuối + Kim loại (trừ K, Na, Ba, Ca, Li) Muối mới + Kim loại mớiTính chất hóa học của muốiBị phân hủy ở nhiệt độ caoTác dụng với bazơ muối mới + bazơ mớiTác dụng với axit Muối mới + Axit mới Tác dụng với muối 2 muối mới Tác dụng với kim loại Muối mới + Kim loại mớiTÝnh chÊt ho¸ häc cña muèi II. Phản ứng trao đổi trong dung dịch: 1- Nhận xét về các phản ứng hóa học của muối. BaCl2 + Na2SO4 BaSO4 + 2NaCl CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 Na2CO3 + H2SO4 Na2SO4 + H2O + CO2 ↑2- Phản ứng trao đổi: Là phản ứng hóa học trong đó hai hợp chất tham gia phản ứng trao đổi với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới.3- Điều kiện xảy ra phản ứng trao đổi: Sản phẩm tạo thành có chất không tan hoặc chất khí. Các phản ứng trao đổi :CuSO4 + 2NaOH Cu(OH)2 (r) + Na2SO4BaCl2 + Na2SO4 BaSO4(r) + 2NaClCaCO3 + HCl CaCl2 + CO2( K) + H2OCuSO4 + HCl CuCl2 + H2SO4NaNO3 + BaCl2 NaCl + Ba(NO3)2K2CO3 + NaOH KOH + Na2CO3ddddddddVì sao không có phản ứng hoá học xảy ra ở các phản ứng sau :dddd 1. Điều kiện xảy ra phản ứng trao đổi?Sản phẩm có chất kết tủa hoặc chất bay hơi.Sản phẩm là chất kết tủaSản phẩm có chất bay hơiBACKhông cần điều kiệnD Bài tập 2: Hãy chọn câu trả lời đúng nhất:2. Cho m(g) muối ăn tác dụng vừa đủ với 17 g dd AgNO3. Sau phản ứng thu được 14,35 g kết tủa AgCl và 8,5 g dung dịch NaNO3. Giá trị của m là:5,85 g5,8 g58,5 gCABKết quả khácDHOẠT ĐỘNG NHÓMThời gian: 05 phút Có các chất trong bảng sau. Hãy chọn chất thích hợp điền vào mỗi sơ đồ phản ứng sau và lập phương trình hóa học.a/ ....... + Fe → FeSO4 + Cub/ ZnSO4 + NaOH → Na2SO4 + . .. c/ .. + AgNO3 → AgCl + HNO3d/ BaSO3 ........ + SO2 e/ Na2CO3 + Ca(NO3)2 → NaNO3 + to22 Bài tập : khi cho 100 g dung dịch HCl tác dụng với CaCO3 ( dư) thì thu được 4,48 lit khí ( ở đktc). a. Viết phương trình phản ứng xảy ra. b. Tính nồng độ phần trăm của dung dịch HCl. c. Tính khối lượng muối thu được sau phản ứng. a. 2HCl + CaCO3 CaCl2 + CO2 + H2Ob. nCO2 = 4,48 / 22,4 = 0,2 mol. Theo pt nHCl = 2n CO2-> n HCl = 0,4 mol -> m HCl = 0,4 x 36,5 = 14,6 gVậy C% HCl = 14,6 x100 / 100 = 14,6 g.c. Tính khối lượng muối thu được sau phản ứng.Theo pt n CaCl2 = n CO2= 0,2 mol=> m CaCl2 = 0,2 x 111 = 22,2 gNH3TraođổAgClKCli12341. Mét lo¹i khÝ mïi khai cã c«ng thøc ho¸ häc lµ:2. Ph¶n øng: CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 thuéc lo¹i ph¶n øng nào?3. C«ng thøc chÊt kÕt tña trong ph¶n øng giữa AgNO3 vµ KCl lµ:4. C«ng thøc hîp chÊt muèi t¹o ra trong ph¶n øng giữa K2CO3 vµ HCl lµ.TRÒ CHƠI Ô CHỮNhóm Hiđroxitvà gốc axitHIĐRO VÀ CÁC KIM LOẠIKINaIAgIMgIICaIIBaIIZnIIPbIICuIIFeIIFeIIIAlIII-OHtt-kttkkkkkk-Clttkttttitttt-NO3tttttttttttt=Sttk-ttkkkkk-=SO3ttkkkkkkkk--=SO4ttitikkktttt=CO3ttkkkkkkkk--=PO4ttkkkkkkkkkkBẢNG TÍNH TAN TRONG NƯỚC CỦA CÁC AXIT – BAZƠ – MUỐICu+ 2AgNO3Cu(NO3)2+ 2AgCuSO4+2NaOH Cu(OH)2 + Na2SO4AgNO3 +CaCl2 2AgCl + Ca(NO3)2 BaCl 2+ H2SO4BaSO4 + 2HClCaCO3 CaO + CO2to3KClO3 2 KCl + 3O2toCÂU HỎI, BÀI TẬP CỦNG CỐCÂU HỎI, BÀI TẬP CỦNG CỐTiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐICÂU HỎI, BÀI TẬP CỦNG CỐBài tập1: Có các chất CuCl2, NaOH, Fe, BaCl2 . Có mấychất tác dụng được với dung dịch muối CuSO4? A. Một chất B. Hai chấtC. Ba chất D. Bốn chấtTiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐICÂU HỎI, BÀI TẬP CỦNG CỐBài tập 2: Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng:A. Quỳ tímB. Dung dịch Ba(NO3)2C. Dung dịch AgNO3D. Dung dịch KOHTiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐIBài tập 4/tr33/SGK:Cho những dung dịch muối sau đây phản ứng với nhau từng đôi một, hãy ghi dấu nhân (x) nếu có phản ứng, dấu(o) nếu không có phản ứng. Viết PTHH ở ô có dấu nhân. Na2CO3 KCl Na2SO4 NaNO3Pb(NO3)2 BaCl2 Na2CO3 KCl Na2SO4 NaNO3Pb(NO3)2 x x x o BaCl2 x o x o 12345678CÂU HỎI, BÀI TẬP CỦNG CỐTiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐI Bµi 4 - sgk trang 33: Na2CO3 KCl Na2SO4 NaNO3 Pb(NO)3 x x x o BaCl2 x o x oPb(NO3)2 + Na2CO3 PbCO3 + 2NaNO3Pb(NO3)2 + 2KCl PbCl2 + 2KNO3Pb(NO3)2 + Na2SO4 PbSO4 + 2NaNO3BaCl2 + Na2CO3 BaCO3 + 2NaClBaCl2 + Na2SO4 BaSO4 + 2NaCl CÂU HỎI, BÀI TẬP CỦNG CỐTiết 14 - Bài 9: TÍNH CHẤT HÓA HỌC CỦA MUỐIHƯỚNG DẪN HỌC SINH TỰ HỌC* Đối với bài học ở tiết học này: - Học bài tính chất hóa học của muối đã học. - Làm bài tập 1,3 trang33 SGK* Đối với bài học ở tiết học tiếp theo: - Chuẩn bị bài: “ Các nội dung còn lại”Tiết 14 - Bài 9:TÍNH CHẤT HÓA HỌC CỦA MUỐICảm ơn quý thầy, cô giáo và các em học sinh!Kính chúc quý thầy, cô giáo cùng các em mạnh khỏe, thành công !Đáp án:Fe + CuSO4 FeSO4 + CuBaCl2 + CuSO4 BaSO4 + CuCl22NaOH + CuSO4 Cu(OH)2 +Na2SO4CÂU HỎI, BÀI TẬP CỦNG CỐBài tập: Viết các PTHH thực hiện chuỗi phản ứng sau: CuO CuSO4 CuCl2 Cu(OH)2Đáp án:(1) CuO + H2SO4 CuSO4 + H2O(2) CuSO4 + BaCl2 BaSO4 + CuCl2(3) CuCl2 + 2NaOH 2NaCl + Cu(OH)2
Tài liệu đính kèm:
 bai_giang_mon_hoa_hoc_lop_9_tiet_14_bai_9_tinh_chat_hoa_hoc.ppt
bai_giang_mon_hoa_hoc_lop_9_tiet_14_bai_9_tinh_chat_hoa_hoc.ppt



