Bài giảng môn Hóa học Lớp 9 - Bài 17: Dãy hoạt động hóa học của kim loại
THẢO LUẬN NHÓM
Hãy đề xuất các thí nghiệm so sánh mức
độ hoạt động hóa học của các kim loại sau:
1) Fe với Cu 2) Cu với Ag
3) Fe; Cu với (H) 4) Na với Fe
Biết trong phòng thí nghiệm có các hóa chất sau:
+ Dung dịch FeSO4; AgNO3; CuSO4; HCl; nước.
+ Kim loại Fe; Cu; Na; Ag và giấy tẩy phenolphtalein.
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng môn Hóa học Lớp 9 - Bài 17: Dãy hoạt động hóa học của kim loại", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
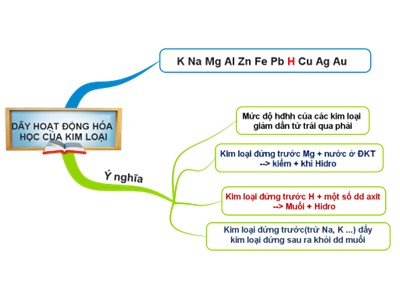
Bài 17: Dãy hoạt động hóa học của kim loại a/ Fe + 2HCl → FeCl 2 + H 2 c/ Zn + CuSO 4 → ZnSO 4 + Cu d/ Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag e/ Ag + CuSO 4 → không phản ứng Hoàn thành các phương trình hóa học sau: a/ Fe + HCl → b/ Zn + CuSO 4 → c/ Cu + AgNO 3 → d/ Ag + CuSO 4 → ĐÁP ÁN KIỂM TRA BÀI CŨ THẢO LUẬN NHÓM Dự đoán mức độ hoạt động hóa học của các kim loại sau: Fe; Cu; Ag; Na và H ? THẢO LUẬN NHÓM Hãy đề xuất các thí nghiệm so sánh mức độ hoạt động hóa học của các kim loại sau: 1) Fe với Cu 2) Cu với Ag 3) Fe; Cu với ( H ) 4) Na với Fe Biết trong phòng thí nghiệm có các hóa chất sau: + Dung dịch FeSO 4 ; AgNO 3 ; CuSO 4 ; HCl; nước. + Kim loại Fe; Cu; Na; Ag và giấy tẩy phenolphtalein. Thí nghiệm Cách tiến hành Hiện tượng Ống 1: Cho đinh sắt vào dung dịch CuSO 4 Ống 2: Cho dây đồng vào dung dịch FeSO 4 Ống 1: Cho dây đồng vào dung dịch AgNO 3 Ống 2: Cho dây bạc vào dung dịch CuSO 4 Ống 1: Cho đinh sắt vào dung dịch HCl Ống 2: Cho dây đồng vào dung dịch HCl Cốc 1: Cho mẩu kim loại Natri vào nước có giấy tẩm phenolphtalein Cốc 2: Cho đinh sắt vào nước có giấy tẩm phenolphtalein Thí nghiệm Thí nghiệm 1 Thí nghiệm 2 Thí nghiệm 3 Thí nghiệm 4 Chú ý khi làm thí nghiệm: Không để hóa chất dính vào da tay, quần áo hoặc các bộ phận khác trên cơ thể; Lượng Na chỉ lấy bằng hạt đỗ xanh; Dùng ống hút lấy dung dịch các chất vào ống nghiệm khoảng từ 1 – 3 ml. Thí nghiệm Tiến hành Hiện tượng + PTHH Ống nghiệm 1 Ống nghiệm 2 Cho đinh sắt vào dd CuSO 4 Cho dây đồng vào dd FeSO 4 Có chất rắn màu đỏ bám ngoài đinh sắt Fe + CuSO 4 → FeSO 4 + Cu Không có hiện tượng xảy ra Nhận xét: Fe hoạt động hóa học mạnh hơn Cu Ta xếp: Fe, Cu Thí nghiệm 1 Thí nghiệm Tiến hành Hiện tượng + PTHH Ống nghiệm1 Ống nghiệm 2 Cho dây đồng vào dd AgNO 3 Cho dây bạc vào dd CuSO 4 Không có hiện tượng xảy ra Có chất rắn màu xám bám ngoài dây đồng Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag Ta xếp : Cu , Ag Nhận xét : Cu hoạt động hóa học mạnh hơn Ag Thí nghiệm 2 Thí nghiệm Tiến hành Hiện tượng + PTHH Ống nghiệm1 Ống nghiệm 2 Cho đinh sắt vào dd HCl Cho dây đồng vào dd HCl Không có hiện tượng xảy ra . Có bọt khí thoát ra , sắt tan dần Fe + 2HCl → FeCl 2 + H 2 Nhận xét: Fe đẩy được Hiđro ra khỏi dd axit , Cu không đẩy được Hiđro ra khỏi dd axit Vậy ta xếp : Fe , (H) ,Cu Thí nghiệm 3 Có bọt khí thoát ra , sắt tan dần Fe + 2HCl → FeCl 2 + H 2 Thí nghiệm Tiến hành Hiện tượng + PTHH Cốc 1 Cho mẩu kim loại Natri vào nước có giấy tẩm phenolphtalein Cốc 2 Cho đinh sắt vào nước có giấy tẩm phenolphtalein Không hiện tượng gì xảy ra 2Na + 2H 2 O → 2NaOH + H 2 Mẩu Na tan dần , giấy có màu đỏ, có khí bay lên Nhận xét: Na hoạt động hóa học mạnh hơn Fe Ta xếp : Na, Fe Thí nghiệm 4 Bằng nhiều thí nghiệm khác nhau, người ta đã xếp được các kim loại thành dãy theo chiều giảm dần mức độ hoạt động hóa học như sau : - Dãy HĐHH của một số kim loại: K, Na, Mg, Al, Zn, Fe, Pb, (H) , Cu, Ag, Au. 1 2 3 4 THẢO LUẬN NHÓM: Hoàn thành các nội dung nêu nên ý nghĩa của dãy hđhh trong bảng sau: K, Na , Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au 1.Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải . 3. Kim loại đứng trước H phản ứng với một số axit ( HCl, H 2 SO 4 loãng ) giải phóng khí H 2 2. Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí hiđro . VD: 2Na + 2H 2 O → 2NaOH + H 2 VD: Fe + 2HCl → FeCl 2 + H 2 VD: Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag 4. Kim loại đứng trước (trừ K, Na..) đẩy kim loại đứng sau ra khỏi dung dịch muối . *Ý nghĩa *Cách ghi nhớ dãy hoạt động hóa học của kim loại K Na Mg Al Zn Fe Pb (H) Cu Ag Au Khi Nào May Áo Záp Sắt Phải Hỏi Cụ Bạc Vàng Bài tập 1 trang 54 SGK Dãy các kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần ? A. K, Mg, Cu, Al, Zn, Fe B. Fe, Cu, K, Mg, Al, Zn C. Cu, Fe, Zn, Al, Mg, K D. Zn, K, Mg, Cu, Al, Fe E. Mg, K, Cu, Al, Fe Đúng rồi Sai rồi Sai rồi Sai rồi Sai rồi Cuûng coá 1. Kim loaïi naøo sau ñaây coù theå taùc duïng vôùi nöôùc ôû ñieàu kieän thöôøng ? D. Caû A vaø C ñeàu ñuùng A. K B. Fe C. Na Bài 2: Chọn đáp án đứng trước câu trả lời đúng 2. Nhöõng kim loaïi naøo sau ñaây taùc duïng vôùi dung dòch H 2 SO 4 ( loaõng ) ? D. Cu, Ag A. Fe, Cu B. Zn, Fe C. Ag, Zn Cho 10,5gam hỗn hợp gồm 2 kim loại Cu, Zn vào dung dịch H 2 SO 4 loãng, dư, người ta thu được 2,24lit khí (đktc) BÀI TẬP VẬN DỤNG HƯỚNG DẪN GiẢI Cu không phản ứng với dd H 2 SO 4 loãng PTHH: Zn + H 2 SO 4 → ZnSO 4 + H 2 0,1 0,1 0,1 a) Viết PTHH b)Tính khối lượng chất rắn còn lại sau phản ứng n H2 m zn = 0,1.65 = 6,5g m Cu còn lại = 10,5 – 6,5 = 4g % Zn = % Cu = 100% - 61,9% = 38,1% c)Tính % kl mỗi kim loại có trong hỗn hợp ban đầu? BÀI TẬP VẬN DỤNG Trong những cặp chất sau, cặp nào tác dụng được với nhau? - Viết các PTHH minh hoạ cho các phản ứng. K + H 2 O b) Zn + HCl c) Cu + HCl d) Zn + CuSO 4 e) Fe + MgCl 2 a) 2 K + 2H 2 O 2KOH + H 2 b) Zn + 2HCl ZnCl 2 + H 2 c) Cu + HCl Kh ông phản ứng d) Zn + CuSO 4 ZnSO 4 + Cu e) Fe + MgCl 2 Kh ông phản ứng K, Na , Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au HƯỚNG DẪN VỀ NHÀ Học thuộc dãy HĐHH của kim loại Ghi nhớ ý nghĩa của dãy - Vận dụng làm bài tập 1, 2, 3, 4 SGK-T54 Xin c¸m ¬n thÇy c« vµ c¸c em Chóc thÇy c« m¹nh khoÎ Chóc c¸c em häc tèt
Tài liệu đính kèm:
 bai_giang_mon_hoa_hoc_lop_9_bai_17_day_hoat_dong_hoa_hoc_cua.ppt
bai_giang_mon_hoa_hoc_lop_9_bai_17_day_hoat_dong_hoa_hoc_cua.ppt



