Đề cương ôn tập Hóa học Lớp 9 - Học kỳ I - Võ Thị Thanh Hiền
KIẾN THỨC CẦN NHỚ:
OXIT:
Oxit bazơ: gồm 1 kim loại (Na, Ca, Ba.) + oxi
Ví dụ: Na2O, CaO, BaO, FeO, Fe2O3.
Oxit axit gồm 1 phi kim (P, S,C.) + oxi
Ví dụ: CO2, SO2, SO3, P2O5.
Ngoài ra còn oxit lưỡng tính: Al2O3, ZnO.
AXIT: gồm H + gốc axit (NO3, SO3, SO4, PO4, Cl.) (nhớ kèm hóa trị)
Ví dụ: HNO3, HCl, H2SO4, H3PO4.
BAZƠ: Gồm kim loại (K, Ba, Ca, Na.) + OH (nhớ kèm hóa trị)
Ví dụ: NaOH, KOH, Ca(OH)2, Ba(OH)2.
MUỐI: gồm kim loại (Na, K, Ca.) + gốc axit (Cl, SO4, NO3.)
(nhớ kèm hóa trị)
Ví dụ: NaCl, CaSO4, KNO3.
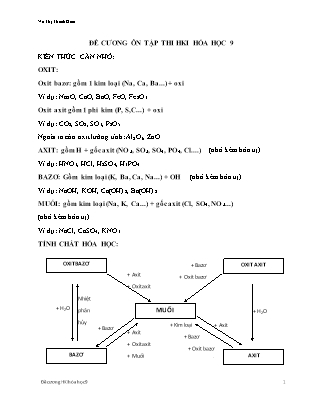
TÍNH CHẤT HÓA HỌC:
Bạn đang xem tài liệu "Đề cương ôn tập Hóa học Lớp 9 - Học kỳ I - Võ Thị Thanh Hiền", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
ĐỀ CƯƠNG ÔN TẬP THI HKI HÓA HỌC 9 KIẾN THỨC CẦN NHỚ: OXIT: Oxit bazơ: gồm 1 kim loại (Na, Ca, Ba...) + oxi Ví dụ: Na2O, CaO, BaO, FeO, Fe2O3... Oxit axit gồm 1 phi kim (P, S,C...) + oxi Ví dụ: CO2, SO2, SO3, P2O5... Ngoài ra còn oxit lưỡng tính: Al2O3, ZnO... AXIT: gồm H + gốc axit (NO3, SO3, SO4, PO4, Cl....) (nhớ kèm hóa trị) Ví dụ: HNO3, HCl, H2SO4, H3PO4... BAZƠ: Gồm kim loại (K, Ba, Ca, Na...) + OH (nhớ kèm hóa trị) Ví dụ: NaOH, KOH, Ca(OH)2, Ba(OH)2... MUỐI: gồm kim loại (Na, K, Ca...) + gốc axit (Cl, SO4, NO3...) (nhớ kèm hóa trị) Ví dụ: NaCl, CaSO4, KNO3... TÍNH CHẤT HÓA HỌC: OXIT AXIT OXIT BAZƠ + Bazơ + Oxit bazơ + Axit + Oxit axit Nhiệt phân hủy + H2O + H2O MUỐI + Kim loại + Bazơ + Oxit bazơ + Muối + Axit + Bazơ + Axit + Oxit axit + Muối AXIT BAZƠ Tính chất hóa học OXIT AXIT OXIT BAZƠ Tác dụng với nước Một số oxit axit (SO2, CO2, N2O5, P2O5, ) + nước →dd axit Vd: CO2 + H2O →H2CO3 P2O5 + 3H2O → 2H3PO4 Một số oxit bazơ (Na2O, BaO, CaO, K2O, ) + nước→dd bazơ Vd: Na2O + H2O → 2NaOH 🞳 Các oxit bazơ như: MgO, CuO, Al2O3, FeO, Fe2O3, không tác dụng với nước. Tác dụng với axit X Oxit bazơ + axit → muối + nước Vd: CuO + 2HCl → CuCl2 + H2O CaO + H2SO4 → CaSO4 + H2O Tác dụng với dd bazơ (kiềm) Oxit axit + dd bazơ → muối + nước Vd: SO2 + Ca(OH)2 → CaSO3 + H2O CO2 + Ba(OH)2→ BaCO3 + H2O X Tác dụng với oxit axit Oxit bazơ + oxit axit → muối Vd: CaO + CO2→CaCO3 Tác dụng với oxit bazơ Oxit axit + oxit bazơ → muối Vd: SO2 + BaO → BaSO3 X Tính chất hóa học của axit Tác dụng với chất chỉ thị: làm giấy quỳ tím → màu đỏ. Tác dụng với kim loại: dd axit (HCl, H2SO4 loãng) + kim loại đứng trước H (trong dãy HĐHH của kim loại) → muối + H2↑ Vd: 2Al + 3H2SO4loãng → Al2(SO4)3 +3H2↑ Zn + 2HCl →ZnCl2 + H2↑ 🞳 H2SO4 đặc và HNO3 tác dụng với hầu hết các kim loại tạo muối nhưng không giải phóng khí H2. Vd: Cu + 2H2SO4đặc→CuSO4 + SO2↑ + 2H2O 🞳 H2SO4 đặc có tính háo nước. Tác dụng với oxit bazơ: Axit + oxit bazơ→muối + nước Vd: CaO + H2SO4 → CaSO4 + H2O Tác dụng với bazơ: Axit + bazơ → muối + nước (phản ứng trung hòa) Vd: 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O Tác dụng với muối: Axit + muối→muối mới + axit mới Vd: H2SO4 + BaCl2 → BaSO4↓ + 2HCl 2HCl + Na2CO3→2NaCl + H2O + CO2↑ 🞳 Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan hoặc chất khí. Tính chất hóa học của bazơ Tác dụng với chất chỉ thị: làm giấy quỳ tím → màu xanh dd phenolphtalein → màu đỏ. Tác dụng với oxit axit: Dd bazơ + oxit axit → muối + nước Vd: Ca(OH)2 + SO3 →CaSO4 + H2O Tác dụng với axit: Bazơ + axit → muối + nước (phản ứng trung hòa) Vd: NaOH + HCl → NaCl + H2O Tác dụng với muối: Dd bazơ + dd muối → muối mới + bazơ mới Vd: Ba(OH)2 + CuSO4 →BaSO4↓+ Cu(OH)2↓ 3NaOH + FeCl3 → Fe(OH)3↓ + 3NaCl 🞳 Điều kiện phản ứng xảy ra: Sản phẩm phải có chất không tan. Phản ứng nhiệt phân: t0 Bazơ không tan→oxit bazơ + nước Vd: Cu(OH)2 →CuO + H2O t0 MỘT SỐ CHẤT QUAN TRỌNG: CANXI OXIT: CaO (vôi sống) – oxit bazơ Tác dụng với nước → dung dịch bazơ CaO + H2O → Ca(OH)2 Tác dụng với axit → muối và nước CaO + 2HCl →CaCl2 + H2O Tác dụng với oxit axit → muối CaO + CO2 →CaCO3 Ứng dụng: khử chua đất trồng trọt, xử lí nước thải công nghiệp, sát trùng, diệt nấm... Điều chế: phân hủy đá vôi thành vôi sống CaCO3 CaO + CO2 LƯU HUỲNH ĐIOXIT: SO2 (khí sunfurơ) – oxit axit- mùi hắc Tác dụng với nước → dung dịch axit SO2 + H2O →H2SO3 Tác dụng với bazơ →muối và nước SO2 + Ca(OH)2 →CaSO3 + H2O Tác dụng với oxit bazơ→ muối SO2 + Na2O →Na2SO3 Ứng dụng: sản xuất H2SO4, dùng làm chất tẩy trắng bột gỗ trong công nghiệp giấy, dùng làm diệt nấm mối... Điều chế: muối sunfit tác dụng với axit. Na2SO3 + H2SO4 →Na2SO4 + SO2 ↑+ H2O AXIT CLOHIĐRIC (HCl) – dung dịch khí hidro clorua TCHH: Làm đổi màu quỳ tím →đỏ Tác dụng với kim loại →muối clorua + H2 Fe + 2HCl→ FeCl2 + H2 ↑ Tác dụng với bazơ →muối clorua và nước HCl + NaOH →NaCl + H2O Tác dụng với oxit bazơ→ muối clorua và nước 2HCl + CuO→ CuCl2 + H2O Ứng dụng : điều chế muối clorua, làm sạch bề mặt kim loại trước khi hàn, chế biến thực phẩm, dược phẩm, tẩy gỉ kim loại trước khi sơn, tráng.... AXIT SUNFURIC ( H2SO4) Cách pha loãng: rót từ từ axit đặc vào nước và không làm ngược lại (chú ý câu này khi nào trắc nghiệm để có điểm). TCHH: AXIT LOÃNG: Làm đổi màu quỳ tím →đỏ Tác dụng với kim loại →muối sunfat + H2 Zn + H2SO4 → ZnSO4 + H2 Tác dụng với bazơ →muối sunfat và nước H2SO4 + Cu(OH)2 →CuSO4 + 2H2O Tác dụng với oxit bazơ→ muối sunfat và nước H2SO4 + CuO →CuSO4 + H2O AXIT ĐẶC: Tác dụng với kim loại → muối sunfat (chú ý phương trình này để viết cho đúng, H2SO4 loãng không tác dụng được với Cu) 2H2SO4 (đ) + Cu CuSO4 + 2SO2 + H2O Tính háo nước: C12H22O11 11H2O + 12C Ứng dụng : luyện kim, phân bón, giấy, chất tẩy rửa... Sản xuất: S + O2 SO2 2SO2 + O2 2SO3 SO3 + H2O → H2SO4 Nhận biết muối sunfat và axit sunfuric: sử dụng chủ yếu là BaCl2 để tạo kết tủa (chú ý dùng nhiều trong bài toán nhận biết). NATRI HIĐROXIT (NaOH)- bazơ, không màu, hút ẩm mạnh, tan trong nước tỏa nhiều nhiệt TCHH: Làm quỳ tím → xanh Dung dich phenolphtalein → hóa đỏ Tác dụng với axit → muối + nước NaOH + HCl → NaCl + H2O Tác dụng với oxit axit → muối + nước 2NaOH + CO2 → Na2CO3 + H2O Ứng dụng: sản xuất xà phòng, chất tẩy rửa, sản xuất tơ nhân tạo, sản xuất giấy, chế biến dầu mỏ... Sản xuất: điện phân dung dịch HCl 2NaCl + 2H2O → 2NaOH + H2 + Cl2 CANXI HIDROXIT ( Ca(OH)2) – nước vôi trong Pha chế: vôi tôi Ca(OH)2 hòa tan trong nước tạo thành vôi nước hay vôi sữa . Lọc vôi nước ta được dung dịch nước vôi trong. TCHH: Làm quỳ tím → xanh Dung dich phenolphtalein → hóa đỏ Tác dụng với axit → muối + nước Ca(OH)2 + 2HCl → CaCl2 + H2O Tác dụng với oxit axit → muối + nước Ca(OH)2 + CO2 → CaCO3 + H2O Ứng dụng: làm vật liệu trong xây dựng, khử chua đất trồng trọt, khử độc các chất thải công nghiệp... THANG pH pH= 7 dung dịch trung tính pH> 7 dung dịch có tính bazơ pH< 7 dung dịch có tính axit KIM LOẠI: TÍNH CHẤT VẬT LÍ: Tính dẻo: dẻo nhất là nhôm (Al) Tính dẫn điện: Ag dẫn điện tốt nhất, sau đó là Cu, Al, Fe... Tính dẫn nhiệt: kim loại nào dẫn điện tốt thì dẫn nhiệt tốt, bạc (Ag) Ánh kim TÍNH CHẤT HÓA HỌC: Tác dụng với oxi: tạo oxit 2Zn + O2 2ZnO 3Fe + 2O2 Fe3O4 (lưu ý phương trình này tạo oxit sắt từ) Tác dụng với phi kim khác: tạo muối 2Na + Cl2 2NaCl Tác dụng với axit: tạo muối và H2 Zn + H2SO4 →ZnSO4 + H2 Phản ứng của kim loại với dung dịch muối Cu + AgNO3 →CuNO3 + Ag Kim loại hoạt động hóa học mạnh hơn có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới. DÃY HOẠT ĐỘNG HÓA HỌC CỦA KIM LOẠI K Na Mg Al Zn Fe Pb (H) Cu Ag Au Ý nghĩa: Mức độ hoạt động hóa học của kim loại giảm dần từ trái sang phải. Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành dung dịch kiềm và giải phóng khí H2. Kim loại đứng trước H phản ứng với dung dịch axit ( HCl, H2SO4 loãng...) giải phóng khí H2. Kim loại đứng trước đẩy kim loại đứng sau ra khỏi dung dịch muối. Tính chất Nhôm Sắt TCVL Là kim loại màu trắng bạc, có ánh kim, nhẹ, dẫn điện, dẫn nhiệt tốt. Là kim loại màu trắng xám, dẫn điện, dẫn nhiệt tốt nhưng kém hơn nhôm. Sắt có tính nhiễm từ. TCHH Tác dụng với phi kim: Tác dụng với oxi: tạo thành oxit 4Al + 3O2 2Al2O3 trắng Tác dụng với phi kim khác: tạo muối 4Al + 3Cl2 2AlCl3 không màu Tác dụng với dung dịch axit: tạo muối + H2 2Al +6HCl →2AlCl3 + 3H2 Tác dụng với dung dịch muối: tạo muối mới + kim loại mới 2Al + 3CuCl2 →2AlCl3 +3Cu Ngoài ra Al còn phản ứng được với dung dịch NaOH (sẽ tìm hiểu kĩ sau). Tác dụng với phi kim: Tác dụng với oxi: tạo oxit sắt từ 3Fe + 2O2 Fe3O4 nâu đỏ Tác dụng với phi kim khác: tạo muối 2Fe + 3Cl22FeCl3 Tác dụng với dung dịch axit: tạo muối + H2 Fe + 2HCl→FeCl2 + H2 Tác dụng với dung dịch muối: tạo muối mới + kim loại mới Fe + CuSO4 → Cu + FeSO4 Chú ý: Al, Fe đều không tác dụng với H2SO4 hay HNO3 đặc nguội. (chú ý để lúc viết ptpu có xảy ra hay không?) ỨNG DỤNG Được sử dụng làm đồ dùng gia đình, dây dẫn điện, vật liệu xây dựng HỢP KIM SẮT: GANG, THÉP Gang là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2-5%, giòn, không rèn, không dát mỏng được. Thép là hợp kim của sắt với cacbon, trong đó hàm lượng của cacbon chiếm dưới 2%, đàn hồi, dẻo, cứng. SỰ ĂN MÒN KIM LOẠI VÀ BẢO VỆ KIM LOẠI KHÔNG BỊ ĂN MÒN Sự ăn mòn kim loại là sự phá hủy kim loại, hợp kim do tác dụng hóa học trong môi trường. Yếu tố ảnh hưởng đến sự ăn mòn kim loại: các chất trong môi trường, ảnh hưởng của nhiệt độ. Biện pháp chống ăn mòn: ngăn không cho kim loại tiếp xúc với môi trường, chế tạo hợp kim ít bị ăn mòn. BÀI TẬP: DẠNG 1: viết các phương trình hóa học thực hiện dãy chuỗi chuyển hóa sau: CaSO3 Na2SO3 Na2SO3 Na2SO4 BaSO4 CaCl2 Ca(NO3)2 Natri →natri oxit →natri hidroxit →natri sunfat →natri clorua Natri cacbonat Magie oxit magie sunfat Magie magie nitrat Magie clorua magie sunfua Nhôm→ nhôm oxit→ nhôm clorua→ nhôm hidroxit→ nhôm oxit →nhôm→ nhôm clorua Sắt →sắt sunfat→ sắt hidroxit →sắt clorua FeCl3→ Fe(OH)3→ Fe2O3→ Fe→ Fe3O4 Fe→FeCl3→ Fe(OH)3→ Fe2(SO4)3→ FeCl3 Fe(NO3)3→ Fe(OH)3 →Fe2O3 →Fe→ FeCl2→ Fe(OH)2 DẠNG 2: NHẬN BIẾT DUNG DỊCH MẤT NHÃN HCl, NaCl, NaOH, H2SO4 NaOH, Ba(OH)2, NaCl HCl, H2SO4, HNO3, NaCl H2SO4, Na2SO4, NaCl, FeCl3 NaCl, NaOH, NaNO3, Na2SO4 Ca(OH)2, NaOH, NaNO3, Ba(OH)2 DẠNG 3: TÍNH TOÁN Cho 1,96 gam sắt tác dụng vừa đủ với dung dịch AgNO3 10%. Tính: Khối lượng dung dịch AgNO3 cần dùng? Khối lượng kim loại thu được sau phản ứng? Cho 122,5 gam dung dịch axit sunfuric 20% vào 400 gam dung dịch bari clorua 5,2%. Tính nồng độ phần trăm các chất có trong dụng dịch sau khi loại bỏ kết tủa. Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit sunfuric. Tính thể tích khí hidro thu được. Cho 0,83 gam hỗn hợp gồm Al, Fe tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được 0,56 lít khí H2 (đktc). Tính thành phần phần trăm khối lượng của Al và Fe có trong hỗn hợp. Hòa tan hoàn toàn 3,25 gam một kim loại X(có hóa trị II) bằng dung dịch H2SO4 loãng thu được 1,12 lít khí H2 (đktc). Tìm kim loại X. 6.Cho 15,5g natri oxit tác dụng với nước thu được 0,5 lít dd bazơ. a. Tính nồng độ mol dd bazơ thu được b. Tính thể tích dd H2SO4 0,5M cần dùng để trung hòa hết bazơ nói trên 7. Cho 200ml dd CuCl2 0,5M tác dụng hết với 150ml dd NaOH. Lọc hỗn hợp các chất sau phản ứng được kết tủa và nước lọc. Nung kết tủa đễn khối lượng không đổi. a. Tính khối lượng chất rắn sau khi nung b. Tính nồng độ mol dd NaOH tham gia phản ứng 8 Cho 5,4g nhôm tác dụng hết với 100ml H2SO4 a. Tính thể tích khí H2 sinh ra (ĐKTC) b. Tính nồng độ mol dd H2SO4 tham gia phản ứng c. Tính thể tích dd NaOH 0,25M để trung hòa hết lượng axit nói trên 9 Cho 10g CaCO3 tác dụng với dd HCl dư a. Tính thể tích khí CO2 thu được (ĐKTC) b. Dẫn khí CO2 thu được ở trên vào lọ đựng dd Ca(OH)2 0.5M. Tính V ml dd c. Ca(OH)2 cần dùng để tác dụng hết với khí CO2 tạo ra sản phẩm có chất kết tủa 10 Cho 1 lượng bột sắt dư vào 150ml dd H2SO4, phản ứng xong người ta thu được 3,36l khí không màu (ĐKTC) a. Tính số gam bột sắt tham gia phản ứng b. Tính nồng độ mol dd axit đã dùng 11. Cho 8g CuO tác dụng hết 200g dd HCl. Tính nồng độ phần trăm dd muối thu được sau phản ứng. 12. Cho dd HCl 2M tác dụng với dd 300ml dd AgNO3 a. Tính khối lượng kết tủa thu được b. Tính thể tích dd axit đã dùng c. Tính CM dd sau phản ứng 13. Cho 4,48l khí CO2 tác dụng vừa hết với 500ml dd NaOH a. Viết PTHH biết sản phẩm thu được là muối trung hòa b. Tính nồng độ mol dd NaOH đã dùng c. Để trung hòa dd bazơ trên ta phải dùng dd H2SO4 14%. Tính khối lượng dd H2SO4 cần dùng cho phản ứng 14. Cho 13g kẽm tác dụng với 200g dd HCl a. Tính khối lượng muối thu được b. Tính nồng độ phần trăm dd axit đã dùng c. Tính nồng độ phần trăm dd thu được sau phản ứng 15. Cho 11,2g sắt tác dụng vừa đủ với 200g dd HCl a. Tính nồng độ phần trăm dd axit đã dùng b. Tính nồng độ phàn trăm dd muối thu được sau phản ứng 16. Cho 200ml dd KOH 2M phản ứng vừa đủ với dd MgSO4 1M a. Tính khối lượng kết tủa thu được b. Tính thể tích dd MgSO4 đã dùng c. Tính nồng độ mol dd K2SO4 thu được sau phản ứng. 17. Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch NaOH 2M. Tính thể tích dung dịch NaOH cần dùng. Tính khối lượng muối tạo thành. Tính nồng độ mol/lit của chất tan có trong dung dịch thu được. 18. Cho một bản nhôm có khối lượng 70g vào dung dịch CuSO4. Sau một thời gian lấy bản nhôm ra, rửa sạch, làm khô, cân lại thấy khối lượng bản nhôm là 76,9g. • Tính khối lượng Cu sinh ra? • Tính khối lượng muối tạo thành? 19. ngâm mộtt lá đồng trong 500ml dung dịch AgNO3 đến khi phản ứng hoàn taon. Lấy lá đòng ra , làm khô, cân thì thấy khối lượng lá đồng tăng thêm 15,2g. Hãy xác định nồng độ mol của dung dịch bạc nitrat.. 20. ngâm sắt dư trong 200ml dung dịch CuSO4 1M .Sau khi phản ứng kết thúc ,lọc kết tủa chất rắn A và dung dịch B. cho A tác dụng với dung dịch HCl dư .Tính khối lượng chất rắn thu được sau phản ứng . tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B .Lọc tách kết tủa đem nung ngoài không khí đến khối lượng không đổi thu được bao nhiêu g chất rắn. 21. cho thanh sắt 15g vào 500ml dung dịch AgNO3 0,1M .Sau khi phản ứng hoàn toàn lấy thanh sắt ra , sấy khô , cân nặng m g và thu được dung dịch A. tính m. cho toàn bộ dung dịch A tác dụng với dung dịch NaOH dư , lọc nung kết tủa ngoài không khí đến khối lượng không đổi thu được bao nhiêu g chất rắn ? 22. cho 78g một kim loại A tác dụng với khí clo dư tạo thành 149 g muối . Hãy xác định kim loại A, biết rằng A có hóa trị 1 . 23. ngâm một lá sắt có khối lượng 28g trong 250ml dung dịch CuSO4 .Sau khi phản ứng hoàn toàn , người ta lấy thanh sắt ra khỏi dung dịch , rữa nhẹ , làm khô thì cân nặng 28,8g . hãy viết phương trình hóa học . tính nồng độ CM của dung dịch CuSO4 . 24 . cho 16,6 g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư .Sau phản ứng thu được 1,12l lít khí (đktc). a)viết cá phương trình hóa học . b)tính thành phần phần trăm theo khối lượng của mỗi kim loại ban đầu . 25. hòa tan hoàn toàn 7,8g hỗn hợp Mg và Al vào dung dịch HCl thì thu đưuọc 8,96 lít khí hidro (đktc) . a)tính % khối lượng mỗi kim loại trong hỗn hợp . b) khi cô cạn dung dịch sau phản ứng thu được bao nhiêu g muối khan? 26. cho 1,2 g kim loại M hóa trị 2 tác dụng hết với clo .Sau phản ứng thu được 4,72g muối . a)xác định kim loại M. b) tính thể tích clo (đktc) đã tham gia phản ứng.
Tài liệu đính kèm:
 de_cuong_on_tap_hoa_hoc_lop_9_hoc_ky_i_vo_thi_thanh_hien.docx
de_cuong_on_tap_hoa_hoc_lop_9_hoc_ky_i_vo_thi_thanh_hien.docx



