Giáo án Hóa học Lớp 9 - Tiết 18: Kiểm tra 1 tiết - Năm học 2020-2021
I. Mục tiêu:
1. Kiến thức
Đánh giá kiến thức của HS về tính chất hoá học của oxit, axit, bazo và muối
2. Kĩ năng
Đánh giá kỹ năng viết PTHH, Mô tả hiện tượng thí nghiệm giải bài tập tính theo PTHH.
3. Thái độ
Giáo dục đức tính tự giác, lòng trung thực cho HS.
II. Chuẩn bị:
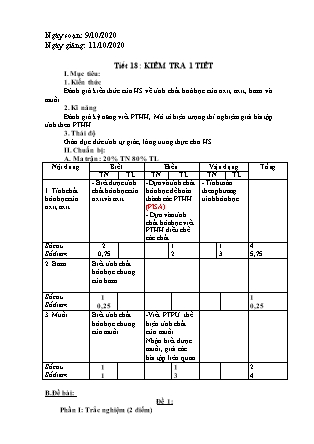
A. Ma trận: 20% TN 80% TL
Nội dung Biết Hiểu Vận dụng Tổng
TN TL TN TL TN TL
1. Tính chất hóa học của oxit, axit - Biết được tính chất hóa học của oxit và axit -Dựa và tính chất hóa học để hoàn thành các PTHH (PISA)
- Dựa vào tính chất hóa học viết PTHH điều chế các chất. - Tính toán theo phương trình hóa học.
Số câu
Số điểm 2
0,75 1
2 1
3 4
5,75
2. Bazơ Biết tính chất hóa học chung của bazơ
Số câu
Số điểm 1
0,25 1
0,25
3. Muối Biết tính chất hóa học chung của muối -Viết PTPƯ thể hiện tính chất của muối
Nhận biết được muối, giải các bài tập liên quan
Số câu
Số điểm 1
1 1
3 2
4
Ngày soạn: 9/10/2020 Ngày giảng: 11/10/2020 Tiết 18: KIỂM TRA 1 TIẾT Mục tiêu: Kiến thức Đánh giá kiến thức của HS về tính chất hoá học của oxit, axit, bazo và muối Kĩ năng Đánh giá kỹ năng viết PTHH, Mô tả hiện tượng thí nghiệm giải bài tập tính theo PTHH. Thái độ Giáo dục đức tính tự giác, lòng trung thực cho HS. Chuẩn bị: A. Ma trận: 20% TN 80% TL Nội dung Biết Hiểu Vận dụng Tổng TN TL TN TL TN TL Tính chất hóa học của oxit, axit - Biết được tính chất hóa học của oxit và axit -Dựa và tính chất hóa học để hoàn thành các PTHH (PISA) - Dựa vào tính chất hóa học viết PTHH điều chế các chất. - Tính toán theo phương trình hóa học. Số câu Số điểm 2 0,75 1 2 1 3 4 5,75 Bazơ Biết tính chất hóa học chung của bazơ Số câu Số điểm 1 0,25 1 0,25 3. Muối Biết tính chất hóa học chung của muối -Viết PTPƯ thể hiện tính chất của muối Nhận biết được muối, giải các bài tập liên quan Số câu Số điểm 1 1 1 3 2 4 B.Đề bài: Đề 1: Phần I: Trắc nghiệm (2 điểm) Câu 1 ( 1 điểm) hãy khoanh tròn vào chữ cái đứng đầu câu trả lời đúng 1.1. Chất có thể tác dụng với nước tạo thành dung dịch làm cho quỳ tím chuyển thành màu đỏ: A.K2O B. P2O5 C. MgO D. SO3 1.2. Oxit nào sau đây không tác dụng với dung dịch HCl A. Fe2O3 B. P2O5 C. CuO D. CaO 1.3. Cặp chất nào sau đây không tác dụng tác dụng được với nhau: A. H2SO4 và BaCl2 B. Fe2O và HCl C.Fe và HCl D. NaOH và Ba(OH)2 Câu 2: Chọn sản phẩm (cột B) tương ứng với thí nghiệm (cột A) và ghi vào cột đáp án sao cho đúng: Cột A (Thí nghiệm) Cột B (Sản phẩm) Đáp án 1. Dung dịch bazơ tác dụng với oxit axit tạo thành a. hai muối mới 1- .. 2. Muối tác dụng với muối tạo thành b. muối mới và axit mới 2- .. 3. Muối tác dụng được với axit sản phẩm là c. Muối mới và bazơ mới 3- .. 4. Muối tác dụng với bazơ sản phẩm tạo thành d. muối và nước 4- .. Phần 2: Tự luận (8 điểm) Câu 1 (2 điểm) SẢN XUẤT AXIT SUNFURIC H2SO4 là một axit vô cơ mạnh, có rất nhiều ứng dụng với nền kinh tế quốc dân. Trong công nghiêp axit H2SO4 được sản xuất bằng phương pháp tiếp xúc. Nguyên liệu là lưu huỳnh (hoặc quạng Pirit) không khí và nước. Em hãy nêu các công đoạn sản xuất axit H2SO4 bằng phương pháp trên? Viết phương trình cho các công đoạn đó? Câu 2. (3 điểm) Trong phòng thí nghiệm có 4 lọ hóa chất đựng lần lượt là NaCl, BaCl2 , Na2CO3 và NaOH bị mất nhẵn. Bằng phương pháp hóa học hãy nhận biết các chất trên.? Câu 3.( 3 điểm) Cho mạt sắt vào dung dịch HCl. Phản ứng xong thu được 5.6 lít khí H2 ( đktc)? a.Viết phương trình hóa học xảy ra? b. Tính khối lượng mạt sắt đã phản ứng? ( Biết Fe = 56) Đề 2: Phần I: Trắc nghiệm (2 điểm) Câu 1 ( 1 điểm) hãy khoanh tròn vào chữ cái đứng đầu câu trả lời đúng 1.1 Chất có thể tác dụng với nước tạo thành dung dịch không làm cho quỳ tím chuyển thành màu đỏ: A. K2O B. P2O5 C. MgO D. SO3 1.2 Oxit nào sau đây dụng với dung dịch HCl A. Fe2O3 B. P2O5 C. CO D. CaO 1.3 Cặp chất nào sau đây không tác dụng tác dụng được với nhau: A. NaOH và HCl B. Fe2O và HCl C.Fe và HCl D. H2SO4 và HCl Câu 2 ( 1 điểm) Hãy chọn đáp án đúng hay sai cho các nhận định sau: Hiện tượng Kết quả Đúng Sai 1.Nhỏ dd Axit H2SO4 vào quỳ tím quỳ tím chuyển sang màu xanh. 2.Sục khí CO2 vào cốc đựng nước vôi trong , nước vôi trong bị vẩn đục 3. Na2O là oxit axit 4.SO2 là oxit bazơ Phần 2: Tự luận (8 điểm) Câu 1 (2 điểm) SẢN XUẤT AXIT SUNFURIC H2SO4 là một axit vô cơ mạnh, có rất nhiều ứng dụng với nền kinh tế quốc dân. Trong công nghiêp axit H2SO4 được sản xuất bằng phương pháp tiếp xúc. Nguyên liệu là lưu huỳnh (hoặc quạng Pirit) không khí và nước. Em hãy nêu các công đoạn sản xuất axit H2SO4 bằng phương pháp trên? Viết phương trình cho các công đoạn đó? Câu 2; (3 điểm) Từ Mg, MgO, Mg(OH)2 và dung dịch axit HCl loãng, hãy viết các phương trình hóa học điều chế Magie Clorua? Câu 3: ( 3 điểm) Cho kim loại kẽm (Zn) vào dung dịch axit HCl. Phản ứng xong thu được 11,2 lít khí H2 ( đktc)? a. Viết phương trình hóa học xảy ra? b. Tính khối lượng Kẽm đã phản ứng? ( Biết Zn = 65) Đáp án và hướng dẫn chấm Đê 1: Phần I. Trắc nghiệm (2đ) Câu 1 Câu 2 Đáp án 1.1- B, D 1.2 - B 1.3- D 1.4-A 1-d 2-a 3-b 4-c Biểu điểm 1,0 đ 1,0 đ Mỗi câu trả lời đúng đạt 0,25 điểm Phần II. Tự luận (8đ) Câu Đáp án Biểu điểm Câu 1 Các công đoạn sản xuất axit sunfuric: Đốt lưu huỳnh trong không khí: S + O2 à SO2 Sản xuất SO3 bằng cách oxi hóa SO2 (xúc tác V2O5 , nhiệt độ) 2SO2 + O2 à 2SO3 Cho SO3 tác dụng với nước: SO3 + H2O à H2SO4 0,5 1,0 0,5 Câu 2 B1: Trích lấy mẫu thử đánh số thứ tự B2: Cho dung dịch H2SO4 vào lần lượt mẫu thử Xuất hiện kết tủa trắng là BaCl2 PTPU: BaCl2 + H2SO4 BaSO4 + 2HCl Xuất hiện khí bay ra là Na2CO3 PTPU: Na2CO3 + H2SO4 Na2SO4 + H2O + CO2 Không có hiện tượng gì là: NaCl và NaOH Sử dụng quỳ tím cho vào lần lượt 2 mẫu còn lại quỳ tím chuyển thành màu xanh là NaOH, không hiện tượng là NaCl 0,5 1 1 0,5 Câu 3 Số mol H2 là : 5,6 : 22,4 = 0,25 (mol) a, PTHH: Fe + 2HCl FeCl2 + H2 0,25 0,25 b. Khối lượng của sắt là: ADCT: m=n.M = 0,25 . 56 = 14(g) 1 1 1 Đê 2 Phần I. Trắc nghiệm (2đ) Câu 1 Câu 2 Đáp án 1.1- B, D 1.2 - B 1.3- D 1-Đ 3-Đ 2-S 4-Đ Biểu điểm 1,0 đ 1,0 đ Mỗi câu trả lời đúng đạt 0,25 điểm Phần II. Tự luận (8đ) Câu Đáp án Biểu điểm Câu 1 Các công đoạn sản xuất axit sunfuric: Đốt lưu huỳnh trong không khí: S + O2 à SO2 Sản xuất SO3 bằng cách oxi hóa SO2 (xúc tác V2O5 , nhiệt độ) 2SO2 + O2 à 2SO3 Cho SO3 tác dụng với nước: SO3 + H2O à H2SO4 0,5 1,0 0,5 Câu 2 Mg + H2SO4 à MgSO4 + H2 MgO + H2SO4 à MgSO4 + H2O Mg(OH)2 H2SO4 à MgSO4 + 2H2O 1 đ 1 đ 1đ Câu 3 Số mol H2 là : 11,2 : 22,4 = 0,5 (mol) a, PTHH: Fe + 2HCl FeCl2 + H2 0,5 0,5 b. Khối lượng của sắt là: ADCT: m=n.M = 0,5 x 56 = 28(g) 1 đ 1 đ 1 đ III. Tổ chức giờ học 1. Ổn định tổ chức 2. Kiểm tra đầu giờ 3. Các hoạt động - Giáo viên phát đề - Theo dõi, quan sát học sinh làm bài - Giáo viên thu bài, nhận xét giờ học 4. Tổng kết, hướng dẫn học ở nhà 1’ a. Tổng kết - GV Thông báo đáp án b. Hướng dẫn học ở nhà - Về xem lại bài - HS chuẩn bị bài mới IV. DỰ KIẾN VÀ PHÂN TÍCH KẾT QUẢ KIỂM TRA 1. Dự kiến kết quả kiểm tra Giỏi: 1 Khá: 17 Trung bình: 12 Yếu: 3 2. Phân tích kết quả kiểm tra Giỏi: Khá: Trung bình: Yếu . . TCM Duyệt
Tài liệu đính kèm:
 giao_an_hoa_hoc_lop_9_tiet_18_kiem_tra_1_tiet_nam_hoc_2020_2.docx
giao_an_hoa_hoc_lop_9_tiet_18_kiem_tra_1_tiet_nam_hoc_2020_2.docx



