Giáo án Hóa học Lớp 9 - Tiết 34: Kiểm tra cuối học kỳ I - Năm học 2020-2021 - Trường THCS Cộng Hòa
I. MỤC TIÊU ĐỀ KIỂM TRA
1. Kiến thức
Chủ đề 1: Các loại hợp chất vô cơ
Chủ đề 2: Kim loại
2. Kĩ năng
+ Tổng hợp kiến thức.
+ Rèn luyện kĩ năng tính toán, áp dụng lý thuyết vào cuộc sống.
3. Thái độ
+ Giáo dục ý thức cẩn thận.
+ lòng yêu thích môn học, đam mê khoa học.
II. CHUẨN BỊ CỦA GV - HS.
1. GV: Đề kiểm tra theo nội dung đã ôn ở tiết ôn tập.
2. HS : Ôn tập các kiến thức theo nội dung tiết ôn tập.
Bạn đang xem tài liệu "Giáo án Hóa học Lớp 9 - Tiết 34: Kiểm tra cuối học kỳ I - Năm học 2020-2021 - Trường THCS Cộng Hòa", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
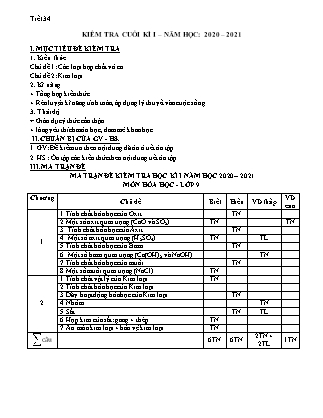
Tiết 34 KIỂM TRA CUỐI KÌ I – NĂM HỌC: 2020 – 2021 I. MỤC TIÊU ĐỀ KIỂM TRA 1. Kiến thức Chủ đề 1: Các loại hợp chất vô cơ Chủ đề 2: Kim loại 2. Kĩ năng + Tổng hợp kiến thức. + Rèn luyện kĩ năng tính toán, áp dụng lý thuyết vào cuộc sống. 3. Thái độ + Giáo dục ý thức cẩn thận. + lòng yêu thích môn học, đam mê khoa học. II. CHUẨN BỊ CỦA GV - HS. 1. GV: Đề kiểm tra theo nội dung đã ôn ở tiết ôn tập. 2. HS : Ôn tập các kiến thức theo nội dung tiết ôn tập. III. MA TRẬN ĐỀ MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I NĂM HỌC 2020 – 2021 MÔN HÓA HỌC - LỚP 9 Chương Chủ đề Biết Hiểu VD thấp VD cao 1 1. Tính chất hóa học của Oxit TN 2. Một số oxit quan trọng (CaO và SO2) TN TN 3. Tính chất hóa học của Axit TN 4. Một số axit quan trọng (H2SO 4) TN TL 5. Tính chất hóa học của Bazơ TN 6. Một số bazơ quan trọng (Ca(OH)2 và NaOH) TN 7. Tính chất hóa học của muối TN 8. Một số muối quan trọng (NaCl) TN 2 1. Tính chất vật lý của Kim loại TN 2. Tính chất hóa học của Kim loại 3. Dãy hoạt động hóa học của Kim loại TN 4. Nhôm TN 5. Sắt TN TL 6. Hợp kim của sắt: gang + thép TN 7. Ăn mòn kim loại + bảo vệ kim loại TN câu 6TN 6TN 2TN + 2TL 1TN PHÒNG GD&ĐT QUỐC OAI TRƯỜNG THCS CỘNG HÒA ĐỀ KIỂM TRA CUỐI KÌ I [2020-2021] TÊN MÔN HỌC: HÓA HỌC 9 Thời gian làm bài: 45 phút (15 câu TN + 2 câu TL) Họ và tên: ..SBD Lớp .. (Thí sinh không được sử dụng tài liệu) Nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Cr = 52; Mn = 55; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137. PHẦN I. TRẮC NGHIỆM (6 điểm) Câu 1. Dãy tất cả các chất gồm oxit axit là A. CO2, SO2, NO. B. CO2, SO3, Na2O. C. SO2, P2O5, NO2. D. H2O, CO, NO. Câu 2. Đâu là ứng dụng của CaO? A. Sản xuất H2SO4. B. Khử chua đất. C. Tẩy trắng gỗ. D. Gây mưa axit. Bài 3. Hòa tan hết 8,4 gam CaO vào 100 gam nước thu được dung dịch A. Nồng độ % của A là A. 12,45%. B. 12%. C. 11,36%. D. 10,06%. Câu 4. Phản ứng hóa học nào sau đây viết sai? A. Ca + H2SO4 à CaSO 4 + H2. B. NaOH + HCl à NaCl + H2O. C. 2Ag + H2SO 4 à Ag2SO4 + H2. D. FeO + 2HCl à FeCl2 + H2O. Câu 5. Muốn pha loãng axit sunfuric đặc ta phải A. Rót nước vào axit đặc. B. Rót từ từ nước vào axit đặc. C. Rót nhanh axit đặc vào nước. D. Rót từ từ axit đặc vào nước. Câu 6. Cho các bazơ sau: KOH, Mg(OH)2, Fe(OH)3, NaOH, Cu(OH)2. Số bazơ bị nhiệt phân là A. 1. B. 2. C. 3. D. 4. Câu 7. Thổi 1,12 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư thu được m (gam) kết tủa trắng. m là A. 5 g. B. 10 g. C. 2,5 g. D. 7,5 g. Câu 8. Để làm sạch dung dịch MgCl2 có lẫn tạp chất FeCl2 ta dùng A. MgSO4. B. HCl. C. Mg. D. Fe. Câu 9. Công thức hóa học của muối ăn là A. NaCl. B. NaNO3. C. KNO 3. D. HCl. Câu10. Trong các loại phân bón sau, phân bón hoá học đơn là A. (NH4)3PO4 B. Ca(H2PO4)2 C. K3PO4 D. KNO3 Câu 11. Thép là hợp kim Fe – C và một số nguyên tố khác, trong đó C chiếm khoảng A. Trên 2%. B. Từ 5-10%. C. Dưới 2%. D. Không có C. Câu 12. Đinh sắt trong ống nghiệm (3) bị ăn mòn nhiều nhất, dung dịch chứa trong ống nghiệm (3) là A. Nước khoáng. B. Nước muối. C. Không khí. D. Dầu hỏa. Câu 13. Cho phản ứng: Fe + H3PO4 → muối X + khí Y. muối X là A. FePO4. B. Fe3(PO4)2. C. Fe2PO4. D. Fe2(PO4)3. Câu 14: Đốt cháy hết 5,4 gam Al trong V (lít) không khí (đktc), thu được Al2O3. Biết, Al chỉ tác dụng với khí oxi trong không khí và thể tích O2 chiếm 20% thể tích không khí. V có giá trị là A. 3,36 lít B. 16,8 lít C. 0,672 lít D. 8,96 lít Câu 15: Cho các kim loại: Na, Fe, Mg, Al, Cu, Ag. Số kim loại tác dụng được với nước ở đk thường là A. 1 B. 2 C. 3 D. 4 PHẦN II. TỰ LUẬN (4 điểm) Câu 1. (2 điểm) Hoàn thành sơ đồ phản ứng sau Cu (1) CuO (2) CuSO4 (3) Cu(NO3)2 (4) Cu(OH)2 Câu 2. (2 điểm) Hòa tan hết 8,1 (g) nhôm trong 500 ml dung dịch H2SO4 x(M) thu được V (lít) khí H2 (đktc). a. Viết phương trình hóa học. b. Tính x c. Tính V ĐÁP ÁN PHẦN I. TRẮC NGHIỆM (6 điểm) – Mỗi ý đúng = 0,4 điểm Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 Câu 7 Câu 8 Câu 9 Câu 10 C B A C D C A C A B Câu 11 Câu 12 Câu 13 Câu 14 Câu 15 C B B B A PHẦN II. TỰ LUẬN (4 điểm) Câu 1. Hoàn thành sơ đồ phản ứng sau Ghi chú Điểm 1) 2Cu + O2 to 2CuO + Viết đúng pthh + Thiếu đk / chưa CB 0,5 đ -0,25 đ b) CuO + H2SO4 à CuSO4 + H2O 0,5 đ c) CuSO4 + Ba(NO3)2 à BaSO4 ↓ + Cu(NO3)2 Thay Ba(NO3)2=Pb(NO3)2 cũng đc 0,5 đ d) Cu(NO3)2 + 2NaOH à Cu(OH)2 ↓ + 2NaNO3 Thay NaOH = KOH = Ca(OH)2 = Ba(OH)2 đều được 0,5 đ Câu 2. Hòa tan hết 8,1 (g) nhôm trong 500 ml dung dịch H2SO4 x(M) thu được V (lít) khí H2 (đktc). a) Viết PTHH. 2Al + 3H2SO4 à Al2(SO4)3 + 3H2 + Viết đúng sơ đồ pư + Cân bằng đúng 0,25 đ 0,25 đ b) nAl = 8,1/27 = 0,3 mol Theo PTHH: nH2SO4 = 0,45 mol è CM H2SO4 = nV= 0,450,5=0,9 M 0,25 đ 0,5 đ c) Theo PTHH: nH2 = 0,45 mol 0,25 đ VH2 = 0,45.22,4 = 10,08 lít 0,5 đ Thiếu đơn vị -0,25 đ Lưu ý: Thí sinh có thể giải theo cách khác vẫn đúng GV vẫn cho điểm tối đa
Tài liệu đính kèm:
 giao_an_hoa_hoc_lop_9_tiet_34_kiem_tra_cuoi_hoc_ky_i_nam_hoc.docx
giao_an_hoa_hoc_lop_9_tiet_34_kiem_tra_cuoi_hoc_ky_i_nam_hoc.docx



