Bài giảng Hóa học Lớp 9 - Tiết 45: Etilen
I. TÍNH CHẤT VẬT LÍ:
Dựa vào thông tin SGK các em tìm hiểu về tính chất vật lí của etilen.
Etilen là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (d = 28/29).
II. CẤU TẠO PHÂN TỬ:
Các em quan sát mô hình phân tử etilen sau:
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng Hóa học Lớp 9 - Tiết 45: Etilen", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
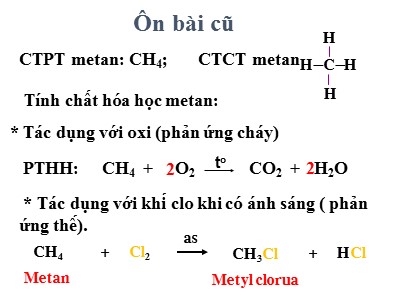
Ôn bài cũCTPT metan: CH4; CTCT metan HH C H H PTHH: CH4 + O2 2toCO2 + H2O 2 * Tác dụng với khí clo khi có ánh sáng ( phản ứng thế).Tính chất hóa học metan: * Tác dụng với oxi (phản ứng cháy) CH4 + Cl2as+ HCl CH3ClMetanMetyl cloruaTiết 45 : ETILENCông thức phân tử :C2H428Phân tử khối : CTPT: C2H4 PTK: 28 I. TÍNH CHẤT VẬT LÍ:Dựa vào thông tin SGK các em tìm hiểu về tính chất vật lí của etilen.Tiết 45 : ETILEN Etilen là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí (d = 28/29).II. CẤU TẠO PHÂN TỬ:Các em quan sát mô hình phân tử etilen sau:MÔ HÌNH PHÂN TỬ ETILENDạng đặcDạng rỗng? Dựa vào mô hình các em hãy viết công thức cấu tạo, công thức viết gọn của etilen ?HHHHCông thức cấu tạo của etilen:CCHHHHViết gọn:CH2CH2Giữa hai nguyên tử cacbon có hai liên kết. Những liên kết như vậy gọi là liên kết đôi.CTPT: C2H4 PTK: 28 Tiết 45 : ETILENII. CẤU TẠO PHÂN TỬ:-Công thức cấu tạo của etilen:CCHHHHCH2CH2- Trong phân tử etilen có một liên kết đôi. Viết gọn: HHHHCCHHCHHETILENMETANsự khác nhau về liên kết của etilen so với metan?Ngoài các liên kết đơn giữa C – H còn có liên kết đôi giữa 2 nguyên tử cacbon C = CChỉ có 4 liên kết đơn C – H HHHHCCTrong liên kết đôi có một liên kết kém bền.Liên kết này dễ bị đứt ra trong các phản ứng hóa học.CTPT: C2H4 PTK: 28 Tiết 45 : ETILENII. CẤU TẠO PHÂN TỬ:-Công thức cấu tạo của etilen:CCHHHHCH2CH2- Trong phân tử etilen có một liên kết đôi. Viết gọn: Trong liên kết đôi có một liên kết kém bền. Liên kết này dễ bị đứt ra trong các phản ứng hóa học. III. Tính chất hóa học:Tương tự metan, etilen cũng có phản ứng cháy, các em hãy viết PTHH ? 1. Etilen có cháy không?2. Etilen có làm mất màu dung dịch brom không?Các em đọc thí nghiệm trang 118 trong SGKPhương trình phản ứng: C2H4 + 3O2 2CO2 + 2H2O toDa cam Không màu? Etilen có làm mất màu dd brom không ?CóDa cam Không màu Etilen làm mất màu dd brom, để nhận biết khí etilen ta dùng dd brom.HHHHHHHH+BrBrNhư vậy liên kết kém bền trong liên kết đôi bị đứt ravà mỗi phân tử etilen đã kết hợp với 1 phân tử brom.Phản ứng trên được gọi là phản ứng cộng.BrBrHHHH+BrBrHHHHBrBrHCCHHH+BrBrHCCHHHBrBrBrBrCH2CH2Đibrometan+CH2CH2BrBrEtilenBromIII. Tính chất hóa học: 1. Etilen có cháy không?2. Etilen có làm mất màu dung dịch brom không? Etilen làm mất màu dd brom (để nhận biết khí etilen ta dùng dd brom).PTHH: C2H4 + Br2 C2H4Br2 EtilenBromĐibrometanPhản ứng trên là phản ứng cộng. Các chất có liên kết đôi (tương tự etilen) dễ tham gia phản ứng cộng.Trong điều kiện thích hợp, Etilen còn có phản ứng cộng với một số chất khác.Vd như hiđro, clo. C2H4 + Cl2 C2H4Cl2t0C2H4 + H2 C2H6t0,xt III. Tính chất hóa học:1. Etilen có cháy không?2. Etilen có làm mất màu dung dịch brôm không?3. Các phân tử etilen có kết hợp được với nhau không? CTPT: C2H4 PTK: 28 Tiết 45 : ETILENHHHHtoCPXúc tácHHHHtoCPXúc tácNếu 2 phân tử Etilen kết hợp với nhau thì ? .....- CH2 – CH2 – CH2 – CH2 - sản phẩm là HHHHtoCPXúc tác Nếu n phân tử Etilen kết hợp với nhau thì ?.......()n(- CH2 – CH2-)nỞ điều kiện thích hợp (nhiệt độ, áp xuất, xúc tác) các phân tử etilen kết hợp với nhau tạo thành phân tử có kích thước và khối lượng rất lớn, gọi là polietilen (PE)sản phẩm là Phản ứng ứng trên là phản ứng trùng hợp:CH2CH2+CH2CH2CH2CH2+Poli etilen (PE) + CH2 = CH2 + CH2 = CH2 + CH2 = CH2 + t0, p, xt 3. Các phân tử etilen có kết hợp được với nhau không?Polietilen là chất rắn, không tan trong nước, không độc. Nó là nguyên liệu quan trọng trong công nghiệp chất dẻo.IV. Ứng dụng:Phản ứng trên là phản ứng trùng hợp.nCH2 = CH2 (- CH2 – CH2 -)nEtilenPolietilen (PE) Ở điều kiện thích hợp (nhiệt độ, áp xuất, xúc tác) các phân tử etilen kết hợp với nhau tạo thành phân tử có kích thước và khối lượng rất lớn, gọi là polietilen (PE)Rượu etylicKích thích quả mau chínPoli etilen (PE)ĐicloetanđicloetanAxit axeticPoli (vinyl clorua) (PVC)IV. Ứng dụng:IV. Ứng dụng: SGK/118Loại hóa chất dạng nước có nguồn gốc từ Trung Quốc mà các thương lái Việt không ngần ngại đem thúc chín các loại trái cây như mít, chuối, đu đủ, sầu riêng là ethrel, loại hóa chất thường chỉ dùng để kích thích mủ cây cao su và cực độc đối với sức khỏe con người.22Da cam Không màu Etilen làm mất màu dd brom, để nhận biết khí etilen ta dùng dd brom.Gỉải Dẫn lần lượt từng khí vào dung dịch brom. Khí nào làm mất màu da cam của dung dịch brom là khí etilen C2H4. Chất khí không làm mất màu dung dịch brom là khí metan CH4. C2H4 + Br2 C2H4Br2 Trình bày phương pháp hóa học nhận biết 2 khí riêng biệt: Metan và Etilen. BT 2/119: Điền từ thích hợp “có” hoặc “không” vào các cột sau:Đặc điểmHợp chấtPhản ứng trùng hợpLàm mất màu dd BromCó liên kết đôiEtilenMetanTác dụng với oxiCó KhôngKhôngKhôngCó Có Có Có Bài 3/119 sgk. Nêu phương pháp hóa học để loại bỏ khí Etilen có lẫn trong khí Metan để thu được khí Metan tinh khiết.Dẫn khí metan có lẫn khí etilen qua dd Brom dư, khí etilen phản ứng với dd Brom còn khí metan không phản ứng, ta thu được khí metan tinh khiếtBài 4/118 sgk. Đốt cháy 4,48 lít khí etilen cần phải dùng:a) Bao nhiêu lít oxi ?b) Bao nhiêu lít không khí chứa 20% thể tích oxi ? Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Giải : VC2H4 nC2H4Lập PTHH. Từ số mol C2H4 nO2 VO2 VKK .nC2H4 = V : 22,4 = 4,48 : 22,4 = 0,2(mol) PTHH: C2H4 + 3O2 2CO2 + 2H2O tonC2H4 = V : 22,4 = 4,48 : 22,4 = 0,2(mol) 0,21 3 2 2 mol 0,60,40,4molThể tích Oxi ( đktc) là: VO2 = n. 22,4 = 0,6 . 22,4 = 13,44 (lít)b) Thể tích không khí chứa 20% thể tích oxi là: VKK = (VO2 . 100) : 20 = (13,44 .100) : 20 = 67,2 (lít)nC2H4 PTHH: C2H4 + Br2 C2H4 Br2 mBr = 8g2nBr = m : M 2VC H = n. 22,424 Cho: Vhh = 3,36 lit mBr = 8g2Tính: %V = ? %V = ?C2H4CH4 %VCH 4%V C2H4 BTVN: Dẫn 3,36 lít hỗn hợp khí gồm CH4 vào C2H4 (đktc) vào dd Brom. Sau phản ứng thấy có 8g Brom tham gia phản ứng. Tính thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp (giả thiết phản ứng xảy ra hoàn toàn). Br = 80.Học bài xem lại các bài tập đã sửa, làm bài tập 1 /119 SGK; Bài tập về nhà cô đã hướng dẫn. Xem trước bài luyện tập chương IV ( phần nào liên quan đến axetilen và Benzen các em không phải xem).Xem trước bài dầu mỏ khí thiên nhiên, nhiên liệuHướng dẫn về nhà
Tài liệu đính kèm:
 bai_giang_hoa_hoc_lop_9_tiet_45_etilen.ppt
bai_giang_hoa_hoc_lop_9_tiet_45_etilen.ppt



