Giáo án môn Hóa học Lớp 9 - Tiết 20: Kiểm tra 1 tiết - Năm học 2020-2021
I. MỤC TIÊU:
1. Kiến thức
Kiểm tra các kiến thức về: tính chất hóa học của các hợp chất vô cơ, phân biệt được các hợp chất vô cơ.
2. Kĩ năng: Rèn luyện kĩ năng tính toán chính xác, làm các bài tập nhận biết,viết các phương trình hoá học thể hiện tính chất của oxit, axit.
3. Thái độ: Tập trung, nghiêm túc làm bài
4. Các năng lực cần hướng tới
- Năng lực ngôn ngữ hoá học
- Năng lực giải quyết vấn đề thông qua môn hoá học
- Năng lực tính toán
II. CHUẨN BỊ CỦA GV VÀ HS
1. Chuẩn bị của GV: Ñeà kieåm tra
2. Chuẩn bị của HS: OÂn taäp về tính chất của oxit, axit, bazơ, muối.
Bạn đang xem tài liệu "Giáo án môn Hóa học Lớp 9 - Tiết 20: Kiểm tra 1 tiết - Năm học 2020-2021", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
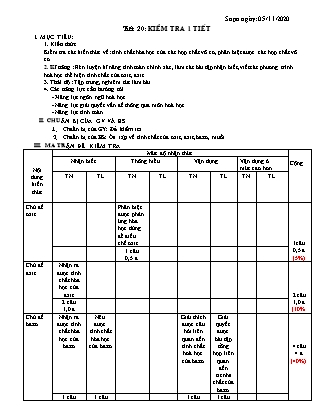
Soạn ngày: 05/11/2020 TiÕt 20: KiÓm tra 1 tiÕt I. MỤC TIÊU: 1. Kiến thức Kiểm tra các kiến thức về: tính chất hóa học của các hợp chất vô cơ, phân biệt được các hợp chất vô cơ. 2. Kĩ năng: Rèn luyện kĩ năng tính toán chính xác, làm các bài tập nhận biết,viết các phương trình hoá học thể hiện tính chất của oxit, axit. 3. Thái độ: Tập trung, nghiêm túc làm bài 4. Các năng lực cần hướng tới - Năng lực ngôn ngữ hoá học - Năng lực giải quyết vấn đề thông qua môn hoá học - Năng lực tính toán II. CHUẨN BỊ CỦA GV VÀ HS Chuẩn bị của GV: Ñeà kieåm tra Chuẩn bị của HS: OÂn taäp về tính chất của oxit, axit, bazơ, muối. III. MA TRẬN ĐỀ KIỂM TRA Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL Chủ đề oxit Phân biệt được phản úng hóa học dùng để điều chế oxit 1câu 0,5 đ (5%) 1 câu 0,5 đ Chủ đề axit Nhận ra được tính chất hóa học của axit 2 câu 1,0 đ (10% 2 câu 1,0 đ Chủ đề bazơ Nhận ra được tính chất hóa học của bazơ Nêu được tính chất hóa học của bazơ Giải thích được câu hỏi liên quan đến tính chất hoá học của bazơ Giải quyết được bài tập tổng hợp liên quan đến ticnhs chất của bazơ 4 câu 4 đ (40%) 1 câu 0,5 đ 1 câu 1,0 đ 1 câu 0,5 đ 1 câu 2 đ Chủ đề muối Nhận ra được tính chất hóa học của Muối Nhận biết muối dựa vào công thức hoá học. Giải thích được câu hỏi liên quan đến tính chất hoá học của muối 3 câu 1,5 đ (15%) 1 câu 0,5 đ 1 câu 0,5 đ 1 câu 0,5 đ Mối liên hệ giữa các hợp chất vô cơ Viết được phương trình thể hiện mối liên hệ giữa các hợp chất vô cơ 1 câu 2,0 đ 1 câu 2,0 đ (20%) Tính toán hóa học Vận dụng tổng hợp kiến thức đã học để tính toán hoá học. 1 câu 1,0 đ 1 câu 1,0 đ (10%) Tổng số câu Tổng số điểm 4 câu 2,0 đ (20%) 1 câu 1,0 đ (10%) 2 câu 1,0 đ (10%) 1 câu 2,0 đ (20%) 2 câu 1,0 đ (10%) 1 câu 2,0 đ (20%) 1 câu 1,0 đ (10%) 12 câu 10,0 đ (100%) III. Néi dung ®Ò: Phần 1: Trắc Nghiệm: (4 ®iÓm) Hãy khoanh tròn vào chữ cái trước câu trả lời đúng: Câu 1: Dung dich HCl tác dụng được với chất nào sau đây H2SO4 B. CuSO4 C. NaOH D. Cu Câu 2: Dung dịch NaOH làm quỳ tím hóa đỏ. B. xanh. C. không đổi màu. D. vàng Câu 3: Dung dịch H2SO4 loãng làm quỳ tím hóa đỏ. B. xanh. C. không đổi màu. D. vàng Câu 4: Để nhận biết muối sunfat (=SO4) người ta dùng thuốc thử Na2SO4 B. NaCl C. Fe D. BaCl2 Câu 5: Dãy các chất sau đây là muối: NaCl, HCl, CuCl2 B. HCl, HNO3, H2SO4 Cu(OH)2, Ca(OH)2, NaOH D. Na2SO4, CaCO3, CuCl2 Câu 6. Khí lưu huỳnh đi oxit được tạo thành từ cặp chất nào sau đây: A. K2SO3 và HCl B.K2SO4 và HCl C. Na2SO3 và NaOH D. Na2SO3 và NaCl Câu 7. Khi để lâu ngoài không khí bề mặt NaOH có phủ một lớp muối đó là muối a. Na2CO3 b. Na2SO4 c. NaCl d. Na3PO4 Câu 8. Dãy chất nào sau đây khi nhiệt phân hoàn toàn, sản phẩm thu được chỉ toàn là oxit a. Fe(OH)2,BaCl2 b. Al(OH)3,AlCl3 c. Fe(OH)2, Al(OH)3 d. CuO,NaCl Phần 2: Tự Luận (8 ®iÓm) Câu 1 (1 điểm): Nêu tính chất hóa học của NaOH, viết phương trình hóa học minh họa? Câu 2 (2 điểm): Hoàn thành chuỗi biến hóa sau: CuO CuCl2 Cu(OH)2 CuSO4 CuCl2 Câu 3 (2 điểm): Biết 2,24 lít CO2 (đktc) tác dụng vừ đủ với 200ml dd Ca(OH)2, sản phẩm là CaCO3 và nước. a. Tính nồng độ mol của dd Ca(OH)2 đã dùng. b. Tính khối lượng chất kết tủa thu được. Câu 4. Nung 8,96 gam Fe trong không khí được hỗn hợp A gồm FeO, Fe3O4, Fe2O3.Hòa tan A vừa đủ trong dung dịch chứa 0,5 mol HNO3, bay ra khí NO là sản phẩm khử duy nhất. Tính số mol NO thoát ra? IV. ĐÁP ÁN – BIỂU ĐIỂM: Phần 1: Trắc Nghiệm: (4điểm) Mỗi câu đúng cho 0,5 điểm. Câu Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 Câu 6 Câu 7 Câu 8 đáp án C B A D D A A C Phần 2: Tự Luận (8 điểm) Câu 1: (1 điểm) Mỗi ý đúng cho 0,25 điểm. Tính chất hóa học của NaOH - làm đổi màu chất chỉ thị: Quỳ tím hóa xanh, phenolphtalein không màu hóa đỏ. - Tác dụng với axit NaOH + HCl → NaCl + H2O - Tác dụng với oxit axit 2 NaOH + CO2 → Na2CO3 + H2O - Tác dụng với muối 2 NaOH + CuCl2 → 2 NaCl + Cu(OH)2 Câu 2: (2 điểm) Mỗi ý đúng cho 0,5 điểm. CuO + 2HCl → CuCl2 + H2O CuCl2 + NaOH → Cu(OH)2+ NaCl Cu(OH)2 + H2SO4 → CuSO4 + 2 H2O CuSO4 + BaCl2 → CuCl2 + BaSO4 Câu 3: (2 điểm) (1 điểm) Phương trình hóa học: CO2 + Ca(OH)2 CaCO3 + H2O Ta có (1 điểm) Câu 4: (1 điểm) (mol) Quy hỗn hợp A gồm (FeO, Fe3O4, Fe2O3) thành hỗn hợp (FeO, Fe2O3) ta có các phương trình hoá học: 2Fe + O2 2FeO x x 4Fe + 3O2 2Fe2O3 y 3FeO + 10HNO3 ¾® 3Fe(NO3)3 + NO + 2H2O x 10. Fe2O3 + 6HNO3 ® 2Fe(NO3)3 + 3H2O 3y Theo bài ra ta có hệ phương trình: Þ Þ mol. V. BỔ SUNG VÀ RÚT KINH NGHIỆM
Tài liệu đính kèm:
 giao_an_mon_hoa_hoc_lop_9_tiet_20_kiem_tra_1_tiet_nam_hoc_20.doc
giao_an_mon_hoa_hoc_lop_9_tiet_20_kiem_tra_1_tiet_nam_hoc_20.doc



