Hệ thống kiến thức Hóa học hữu cơ Lớp 9 - Phạm Phúc Đức Anh
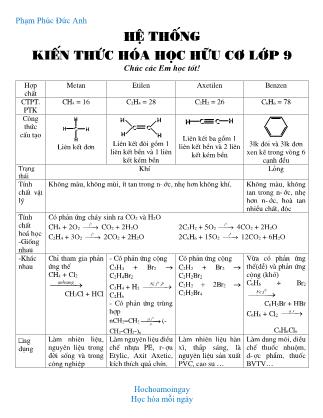
Công thức cấu tạo
Liên kết đơn Liên kết đôi gồm 1
liên kết bền và 1 liên
kết kém bền
Liên kết ba gồm 1
liên kết bền và 2 liên
kết kém bền
3lk đôi và 3lk đơn
xen kẽ trong vòng 6
cạnh đều
Trạng thái
Khí Lỏng
Tính chất vật lý
Không màu, không mùi, ít tan trong n-ớc, nhẹ hơn không khí. Không màu, không
tan trong n-ớc, nhẹ
hơn n-ớc, hoà tan
nhiều chất, độc
Bạn đang xem tài liệu "Hệ thống kiến thức Hóa học hữu cơ Lớp 9 - Phạm Phúc Đức Anh", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
Phạm Phỳc Đức Anh Hochoamoingay Học húa mỗi ngày Hệ thống kiến thức hóa học hữu cơ lớp 9 Chúc các Em học tốt! Hợp chất Metan Etilen Axetilen Benzen CTPT. PTK CH4 = 16 C2H4 = 28 C2H2 = 26 C6H6 = 78 Công thức cấu tạo Liên kết đơn Liên kết đôi gồm 1 liên kết bền và 1 liên kết kém bền Liên kết ba gồm 1 liên kết bền và 2 liên kết kém bền 3lk đôi và 3lk đơn xen kẽ trong vòng 6 cạnh đều Trạng thái Khí Lỏng Tính chất vật lý Không màu, không mùi, ít tan trong n-ớc, nhẹ hơn không khí. Không màu, không tan trong n-ớc, nhẹ hơn n-ớc, hoà tan nhiều chất, độc Tính chất hoá học -Giống nhau Có phản ứng cháy sinh ra CO2 và H2O CH4 + 2O2 0t CO2 + 2H2O C2H4 + 3O2 0t 2CO2 + 2H2O 2C2H2 + 5O2 0t 4CO2 + 2H2O 2C6H6 + 15O2 0t 12CO2 + 6H2O -Khác nhau Chỉ tham gia phản ứng thế CH4 + Cl2 anhsang CH3Cl + HCl - Có phản ứng cộng C2H4 + Br2 C2H4Br2 C2H4 + H2 0, ,Ni t P C2H6 - Có phản ứng trùng hợp nCH2=CH2 0,xt t p (- CH2-CH2-)n Có phản ứng cộng C2H2 + Br2 C2H2Br2 C2H2 + 2Br2 C2H2Br4 Vừa có phản ứng thế(dễ) và phản ứng cộng (khó) C6H6 + Br2 0,Fe t C6H5Br + HBr C6H6 + Cl2 .a s C6H6Cl6 ứng dụng Làm nhiên liệu, nguyên liệu trong đời sống và trong công nghiệp Làm nguyên liệu điều chế nhựa PE, r-ợu Etylic, Axit Axetic, kích thích quả chín. Làm nhiên liệu hàn xì, thắp sáng, là nguyên liệu sản xuất PVC, cao su Làm dung môi, diều chế thuốc nhuộm, d-ợc phẩm, thuốc BVTV C H H H H C H H H C H C HH C Phạm Phỳc Đức Anh Hochoamoingay Học húa mỗi ngày Điều chế Có trong khí thiên nhiên, khí đồng hành, khí bùn ao. Sp chế hoá dầu mỏ, sinh ra khi quả chín C2H5OH 0 2 4 ,H SO d t C2H4 + H2O Cho đất đèn + n-ớc, sp chế hoá dầu mỏ CaC2 + H2O C2H2 + Ca(OH)2 Sản phẩm ch-ng nhựa than đá. Nhận biết Khôg làm mất màu dd Br2 Làm mất màu Clo ngoài as Làm mất màu dung dịch Brom Làm mất màu dung dịch Brom nhiều hơn Etilen Ko làm mất màu dd Brom Ko tan trong n-ớc r-ợu Etylic Axit Axetic Công thức CTPT: C2H6O CTCT: CH3 – CH2 – OH CTPT: C2H4O2 C - C - O - HH H H O CTCT: CH3 – COOH Tính chất vật lý Là chất lỏng, không màu, dễ tan và tan nhiều trong n-ớc. Sôi ở 78,30C, nhẹ hơn n-ớc, hoà tan đ-ợc nhiều chất nh- Iot, Benzen Sôi ở 1180C, có vị chua (dd Ace 2-5% làm giấm ăn) Tính chất hoá học. - Phản ứng với Na: 2C2H5OH + 2Na 2C2H5ONa + H2 2CH3COOH + 2Na 2CH3COONa + H2 - R-ợu Etylic tác dụng với axit axetic tạo thành este Etyl Axetat CH3COOH + C2H5OH 𝐻2𝑆𝑂4đặ𝑐,𝑡0 → CH3COOC2H5 + H2O - Cháy với ngọn lửa màu xanh, toả nhiều nhiệt C2H6O + 3O2 0t 2CO2 + 3H2O - Bị OXH trong kk có men xúc tác C2H5OH + O2 mengiam CH3COOH + H2O - Mang đủ tính chất của axit: Làm đỏ quỳ tím, tác dụng với kim loại tr-ớc H, với bazơ, oxit bazơ, dd muối 2CH3COOH + Mg (CH3COO)2Mg + H2 CH3COOH + NaOH CH3COONa + H2O ứng dụng Dùng làm nhiên liệu, dung môi pha sơn, chế r-ợu bia, d-ợc phẩm, điều chế axit axetic và cao su Dùng để pha giấm ăn, sản xuất chất dẻo, thuốc nhuộm, d-ợc phẩm, tơ Điều chế Bằng ph-ơng pháp lên men tinh bột hoặc đ-ờng C6H12O6 030 32 Men C 2C2H5OH + 2CO2 Hoặc cho Etilen hợp n-ớc - Lên men dd r-ợu nhạt C2H5OH + O2 mengiam CH3COOH + H2O - Trong PTN: c h och h h h h Phạm Phỳc Đức Anh Hochoamoingay Học húa mỗi ngày C2H4 + H2O ddaxit C2H5OH 2CH3COONa + H2SO4 2CH3COOH + Na2SO4 glucozơ saccarozơ tinh bột và xenlulozơ Công thức phân tử C6H12O6 C12H22O11 (C6H10O5)n Tinh bột: n 1200 – 6000 Xenlulozơ: n 10000 – 14000 Trạng thái Tính chất vật lý Chất kết tinh, không màu, vị ngọt, dễ tan trong n-ớc Chất kết tinh, không màu, vị ngọt sắc, dễ tan trong n-ớc, tan nhiều trong n-ớc nóng Là chất rắn trắng. Tinh bột tan đ-ợc trong n-ớc nóng hồ tinh bột. Xenlulozơ không tan trong n-ớc kể cả đun nóng Tính chất hoá học quan trọng Phản ứng tráng g-ơng C6H12O6 + Ag2O C6H12O7 + 2Ag Thuỷ phân khi đun nóng trong dd axit loãng C12H22O11 + H2O , oddaxit t C6H12O6 + C6H12O6 glucozơ fructozơ Thuỷ phân khi đun nóng trong dd axit loãng (C6H10O5)n + nH2O , oddaxit t nC6H12O6 Hồ tinh bột làm dd Iot chuyển màu xanh ứng dụng Thức ăn, d-ợc phẩm Thức ăn, làm bánh kẹo Pha chế d-ợc phẩm Tinh bột là thức ăn cho ng-ời và động vật, là nguyên liệu để sản xuất đ-ờng Glucozơ, r-ợu Etylic. Xenlulozơ dùng để sản xuất giấy, vải, đồ gỗ và vật liệu xây dựng. Điều chế Có trong quả chín (nho), hạt nảy mầm; điều chế từ tinh bột. Có trong mía, củ cải đ-ờng Tinh bột có nhiều trong củ, quả, hạt. Xenlulozơ có trong vỏ đay, gai, sợi bông, gỗ Nhận biết Phản ứng tráng g-ơng Có phản ứng tráng g-ơng khi đun nóng trong dd axit Nhận ra tinh bột bằng dd Iot: có màu xanh đặc tr-ng Phạm Phỳc Đức Anh Hochoamoingay Học húa mỗi ngày Follow, tim để nhận được nhiều tài liệu miễn phớ nhộ cỏc em !
Tài liệu đính kèm:
 he_thong_kien_thuc_hoa_hoc_huu_co_lop_9_pham_phuc_duc_anh.pdf
he_thong_kien_thuc_hoa_hoc_huu_co_lop_9_pham_phuc_duc_anh.pdf



