Tài liệu hệ thống kiến thức môn Hóa học Lớp 9 - Phần Hữu cơ - Tô Thùy Linh
METAN
1) Có hai bình khí khác nhau là CH4 và CO2. Để phân biệt các chất ta có thể dùng.
A) Một kim loại B) Ca(OH)2 C) Nước brom D) Tất cả đều sai
2) Khi đốt cháy hoàn toàn 3,36 lít khí metan (đktc). Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành ? (các khí đo ở đktc)
3) Đốt cháy hoàn toàn khí metan trong bình chứa 4,48 lít khí oxi. Hãy tính thể tích khí metan đã dùng, thể tích khí cacbonic tạo thành, khối lượng nước tạo thành ? (các khí đo ở đktc)
4) Đốt cháy hoàn toàn khí metan trong bình chứa khí oxi vừa đủ thu được 11 g khí cacbonic. Hãy tính thể tích khí metan đã dùng, khối lượng khí oxi đã dùng?
5) Đốt cháy V lít khí metan, thu được 1,8g hơi nước. Hãy tính V và thể tích không khí cần dùng, biết O2 chiếm 20% thể tích không khí (đktc) ?
6) Đốt cháy hoàn toàn 2,24 lít khí C4H10 (đktc) rồi hấp thụ hết các sản phẩm cháy vào dd Ba(OH)2 0,2M dùng dư thu được chất kết tủa.
a) Viết ptpư ?
b) Tìm số g kết tủa thu được.
7) Đốt cháy 10,08 lít hh khí CH4 và C2H6 thu được 14,56 lít CO2. (đktc)
a) Tính % mỗi khí trong hh
b) Dẫn toàn bộ sp cháy qua dd Ba(OH)2 dư thu được a gam kết tủa. Tính a ?
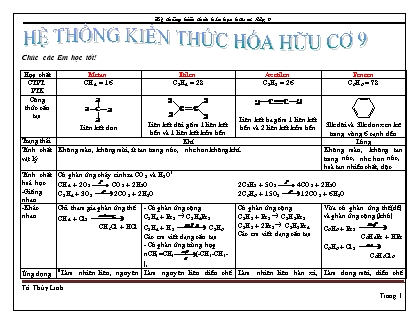
Chóc c¸c Em häc tèt! Hîp chÊt Metan Etilen Axetilen Benzen CTPT. PTK CH4 = 16 C2H4 = 28 C2H2 = 26 C6H6 = 78 C«ng thøc cÊu t¹o Liªn kÕt ®¬n Liªn kÕt ®«i gåm 1 liªn kÕt bÒn vµ 1 liªn kÕt kÐm bÒn Liªn kÕt ba gåm 1 liªn kÕt bÒn vµ 2 liªn kÕt kÐm bÒn 3lk ®«i vµ 3lk ®¬n xen kÏ trong vßng 6 c¹nh ®Òu Tr¹ng th¸i KhÝ Láng TÝnh chÊt vËt lý Kh«ng mµu, kh«ng mïi, Ýt tan trong níc, nhÑ h¬n kh«ng khÝ. Kh«ng mµu, kh«ng tan trong níc, nhÑ h¬n níc, hoµ tan nhiÒu chÊt, ®éc TÝnh chÊt ho¸ häc -Gièng nhau Cã ph¶n øng ch¸y sinh ra CO2 vµ H2O CH4 + 2O2 CO2 + 2H2O C2H4 + 3O2 2CO2 + 2H2O 2C2H2 + 5O2 4CO2 + 2H2O 2C6H6 + 15O2 12CO2 + 6H2O -Kh¸c nhau ChØ tham gia ph¶n øng thÕ CH4 + Cl2 CH3Cl + HCl - Cã ph¶n øng céng C2H4 + Br2 ® C2H4Br2 C2H4 + H2 C2H6 C¸c em viÕt d¹ng cÊu t¹o - Cã ph¶n øng trïng hîp nCH2=CH2(-CH2-CH2-)n Cã ph¶n øng céng C2H2 + Br2 ® C2H2Br2 C2H2 + 2Br2 ® C2H2Br4 C¸c em viÕt d¹ng cÊu t¹o Võa cã ph¶n øng thÕ(dÔ) vµ ph¶n øng céng (khã) C6H6 + Br2 C6H5Br + HBr C6H6 + Cl2 C6H6Cl6 øng dông Lµm nhiªn liÖu, nguyªn liÖu trong ®êi sèng vµ trong c«ng nghiÖp Lµm nguyªn liÖu ®iÒu chÕ nhùa PE, rîu Etylic, Axit Axetic, kÝch thÝch qu¶ chÝn. Lµm nhiªn liÖu hµn x×, th¾p s¸ng, lµ nguyªn liÖu s¶n xuÊt PVC, cao su Lµm dung m«i, diÒu chÕ thuèc nhuém, dîc phÈm, thuèc BVTV §iÒu chÕ Cã trong khÝ thiªn nhiªn, khÝ ®ång hµnh, khÝ bïn ao. Sp chÕ ho¸ dÇu má, sinh ra khi qu¶ chÝn C2H5OH C2H4 + H2O Cho ®Êt ®Ìn + níc, sp chÕ ho¸ dÇu má CaC2 + H2O ® C2H2 + Ca(OH)2 S¶n phÈm chng nhùa than ®¸. NhËn biÕt Kh«g lµm mÊt mµu dd Br2 Lµm mÊt mµu Clo ngoµi as Lµm mÊt mµu dung dÞch Brom Lµm mÊt mµu dung dÞch Brom nhiÒu h¬n Etilen Ko lµm mÊt mµu dd Brom Ko tan trong níc rîu Etylic Axit Axetic C«ng thøc CTPT: C2H6O CTCT: CH3 – CH2 – OH CTPT: C2H4O2 CTCT: CH3 – COOH TÝnh chÊt vËt lý Lµ chÊt láng, kh«ng mµu, dÔ tan vµ tan nhiÒu trong níc. S«i ë 78,30C, nhÑ h¬n níc, hoµ tan ®îc nhiÒu chÊt nh Iot, Benzen S«i ë 1180C, cã vÞ chua (dd Ace 2-5% lµm giÊm ¨n) TÝnh chÊt ho¸ häc. Ph¶n øng víi Na: 2C2H5OH + 2Na ® 2C2H5ONa + H2 2CH3COOH + 2Na ® 2CH3COONa + H2 Rîu Etylic t¸c dông víi axit axetic t¹o thµnh este Etyl Axetat CH3COOH + C2H5OH ®CH3COOC2H5 + H2O Ch¸y víi ngän löa mµu xanh, to¶ nhiÒu nhiÖt C2H6O + 3O2 2CO2 + 3H2O BÞ OXH trong kk cã men xóc t¸c C2H5OH + O2 CH3COOH + H2O - Mang ®ñ tÝnh chÊt cña axit: Lµm ®á quú tÝm, t¸c dông víi kim lo¹i tríc H, víi baz¬, oxit baz¬, dd muèi 2CH3COOH + Mg ® (CH3COO)2Mg + H2 CH3COOH + NaOH ® CH3COONa + H2O øng dông Dïng lµm nhiªn liÖu, dung m«i pha s¬n, chÕ rîu bia, dîc phÈm, ®iÒu chÕ axit axetic vµ cao su Dïng ®Ó pha giÊm ¨n, s¶n xuÊt chÊt dÎo, thuèc nhuém, dîc phÈm, t¬ §iÒu chÕ B»ng ph¬ng ph¸p lªn men tinh bét hoÆc ®êng C6H12O6 2C2H5OH + 2CO2 HoÆc cho Etilen hîp níc C2H4 + H2O C2H5OH Lªn men dd rîu nh¹t C2H5OH + O2 CH3COOH + H2O Trong PTN: 2CH3COONa + H2SO4 ® 2CH3COOH + Na2SO4 glucoz¬ saccaroz¬ tinh bét vµ xenluloz¬ C«ng thøc ph©n tö C6H12O6 C12H22O11 (C6H10O5)n Tinh bét: n » 1200 – 6000 Xenluloz¬: n » 10000 – 14000 Tr¹ng th¸i TÝnh chÊt vËt lý ChÊt kÕt tinh, kh«ng mµu, vÞ ngät, dÔ tan trong níc ChÊt kÕt tinh, kh«ng mµu, vÞ ngät s¾c, dÔ tan trong níc, tan nhiÒu trong níc nãng Lµ chÊt r¾n tr¾ng. Tinh bét tan ®îc trong níc nãng ® hå tinh bét. Xenluloz¬ kh«ng tan trong níc kÓ c¶ ®un nãng TÝnh chÊt ho¸ häc quan träng Ph¶n øng tr¸ng g¬ng C6H12O6 + Ag2O ® C6H12O7 + 2Ag Thuû ph©n khi ®un nãng trong dd axit lo·ng C12H22O11 + H2O C6H12O6 + C6H12O6 glucoz¬ fructoz¬ Thuû ph©n khi ®un nãng trong dd axit lo·ng (C6H10O5)n + nH2O nC6H12O6 Hå tinh bét lµm dd Iot chuyÓn mµu xanh øng dông Thøc ¨n, dîc phÈm Thøc ¨n, lµm b¸nh kÑo Pha chÕ dîc phÈm Tinh bét lµ thøc ¨n cho ngêi vµ ®éng vËt, lµ nguyªn liÖu ®Ó s¶n xuÊt ®êng Glucoz¬, rîu Etylic. Xenluloz¬ dïng ®Ó s¶n xuÊt giÊy, v¶i, ®å gç vµ vËt liÖu x©y dùng. §iÒu chÕ Cã trong qu¶ chÝn (nho), h¹t n¶y mÇm; ®iÒu chÕ tõ tinh bét. Cã trong mÝa, cñ c¶i ®êng Tinh bét cã nhiÒu trong cñ, qu¶, h¹t. Xenluloz¬ cã trong vá ®ay, gai, sîi b«ng, gç NhËn biÕt Ph¶n øng tr¸ng g¬ng Cã ph¶n øng tr¸ng g¬ng khi ®un nãng trong dd axit NhËn ra tinh bét b»ng dd Iot: cã mµu xanh ®Æc trng METAN Có hai bình khí khác nhau là CH4 và CO2. Để phân biệt các chất ta có thể dùng. A) Một kim loại B) Ca(OH)2 C) Nước brom D) Tất cả đều sai Khi đốt cháy hoàn toàn 3,36 lít khí metan (đktc). Hãy tính thể tích khí oxi cần dùng và thể tích khí cacbonic tạo thành ? (các khí đo ở đktc) Đốt cháy hoàn toàn khí metan trong bình chứa 4,48 lít khí oxi. Hãy tính thể tích khí metan đã dùng, thể tích khí cacbonic tạo thành, khối lượng nước tạo thành ? (các khí đo ở đktc) Đốt cháy hoàn toàn khí metan trong bình chứa khí oxi vừa đủ thu được 11 g khí cacbonic. Hãy tính thể tích khí metan đã dùng, khối lượng khí oxi đã dùng? Đốt cháy V lít khí metan, thu được 1,8g hơi nước. Hãy tính V và thể tích không khí cần dùng, biết O2 chiếm 20% thể tích không khí (đktc) ? Đốt cháy hoàn toàn 2,24 lít khí C4H10 (đktc) rồi hấp thụ hết các sản phẩm cháy vào dd Ba(OH)2 0,2M dùng dư thu được chất kết tủa. Viết ptpư ? Tìm số g kết tủa thu được. Đốt cháy 10,08 lít hh khí CH4 và C2H6 thu được 14,56 lít CO2. (đktc) Tính % mỗi khí trong hh Dẫn toàn bộ sp cháy qua dd Ba(OH)2 dư thu được a gam kết tủa. Tính a ? ETILEN Hiện tượng gì xảy ra khi dẫn khí C2H4 qua dd Br2. Viết PTHH. Chọn những câu đúng trong các câu sau: a) CH4 làm mất màu dd brom b) C2H4 tham gia phản ứng thế với clo tương tự CH4 c) CH4 và C2H4 đều có phản ứng cháy sinh ra CO2 và H2O d) C2H4 tham gia phản ứng cộng với brom trong dd e) CH4 và C2H4 đều có phản ứng trùng hợp Một hỗn hợp khí gồm C2H4 và CO2. Để thu khí C2H4 tinh khiết ta dùng hợp chất sau: A) Ca(OH)2 dư B) dd Br2 dư C) dd HCl dư D) Tất cả đều sai Phản ứng cháy giữa etilen và oxi. Tỉ lệ giữa số mol CO2 và số mol H2O sinh ra là: A) 1 : 1 B) 2: 1 C) 1:2 D) Kết quả khác Làm thế nào để Nhận biết 3 chất khí: CO2, CH4, C2H4 ? Đốt cháy V lít etylen, thu được 9g hơi nước. Hãy tính V và thể tích không khí cần dùng, biết O2 chiếm 20% thể tích không khí (đktc) ? Cho 2,8 lít hỗn hợp metan và etilen (đktc) lội qua dung dịch brom (dư), người ta thu được 4,7 gam đibrometan. a) Viết phương trình phản ứng xảy ra. b) Tính thành phần phần trăm của hỗn hợp theo thể tích. Cho 5,6 lít (đktc) hỗn hợp CH4 và C2H4 đi qua nước brom dư thấy có 4 g brom tham gia phản ứng. Viết phương trình phản ứng xảy ra ? Tính thành phần phần trăm thể tích mỗi chất đã dùng ? Tính thể tích O2 cần dùng để đốt cháy hoàn toàn hỗn hợp khí ban đầu ? (đktc) Đốt cháy hết 36 gam hh khí C3H6 và C2H6 trong O2 dư thu được 56 lít CO2 đktc a) Tính V mỗi khí ở đktc b) Tính % mỗi khí trong hh khí ban đầu Đốt cháy hoàn toàn 1,68 lít hỗn hợp gồm 2 khí CH4 và C2H4. Dẫn toàn bộ khí sinh ra qua bình đựng dd Ba(OH)2 dư thấy trong bình có 19,7g kết tủa. a) Viết pthh ? b) Tính thành phần % thể tích mỗi khí trong hỗn hợp ? c) Tính thể tích không khí đủ cho phản ứng cháy ? (đktc) Đốt cháy hoàn toàn 0,3 mol hỗn hợp gồm metan và etilen. Lấy toàn bộ CO2 sinh ra cho vào dd Ca(OH)2 dư thu được 40g kết tủa. Viết pthh xảy ra ? Tính % thể tích mỗi khí ban đầu ? AXETILEN Viết phương trình hoá học biểu diễn phản ứng cháy của metan, etilen, axetilen với oxi. Nhận xét tỉ lệ số mol CO2 và số mol H2O sinh ra sau phản ứng ở mỗi PTHH. Cho 11,2 lít hỗn hợp metan và axetilen (đo ở đktc) đi qua dung dịch brom dư thấy có 8 gam Brom tham gia phản ứng : a. Viết các phương trình phản ứng xảy ra. b. Tính khối lượng C2H2Br4 thu được sau phản ứng. c. Tính phần trăm về thể tích của mỗi khí trong hỗn hợp đầu. Đốt cháy hoàn toàn 16,8 lít khí axetilen. a) Viết phương trình hoá học của phản ứng xảy ra. b) Tính thể tích khí oxi, thể tích không khí cần dùng để đốt cháy hết lượng axetilen này. Biết rằng thể tích khí đo ở đktc và không khí chứa 20% thể tích oxi. c) Tính khối lượng khí cacbonic và hơi nước tạo thành sau phản ứng. d) Nếu dẫn sản phẩm đốt cháy vào dung dịch nước vôi trong dư thì sau thí nghiệm sẽ thu được bao nhiêu gam chất kết tủa. Cho 0,56 lítđktc) hỗn hợp khí gồm C2H4, C2H2 tác dụng hết với dung dịch Br2 dư, lượng Br2 đã tham gia phản ứng là 5,6 gam. a) Hãy viết phương trình phản ứng ? b) Tính thành phần % thể tích của mỗi khí trong hỗn hợp (biết Br = 80). Đốt cháy một lượng hỗn hợp metan và axetilen thu được 13,2 g CO2 và 5,4 g H2O. Tính thành phần % theo thể tích mỗi khí trong hỗn hợp ? BENZEN Cặp chất nào dưới đây có thể cùng làm mất màu dd brom: A) C6H6 và CH4 B) CH4 và C2H6 C) C2H4 và C2H2 D) C2H4 và C6H12 Hãy ghép các tính chất ở cột phải phù hợp với hiđrocacbon ở cột trái. Hiđrocacbon Tính chất A. Metan 1. Trạng thái lỏng B. Etilen 2. Trạng thái khí C. Axetilen 3. Phản ứng cháy D. Benzen 4. Phản ứng thế 5. Phản ứng cộng 6. Phản ứng trùng hợp Điền vào chỗ trống công thức hoá học và điều kiện thích hợp. 1. CH2 = CH2 + ? C2H5OH 2. ? + Cl2 CH3Cl + ? 3. C6H6 + ? C6H5Br + ? Biết rằng benzen cũng có phản ứng thế với clo như với brom. Cho clo dư tác dụng với 78 g benzen (có mặt bột sắt) thu được 78g clobenzen. Tính hiệu suất của phản ứng ? Cho benzen tác dụng với brom có xúc tác là bột sắt, thu được 3,925 g brombenzen. Tính khối lượng các chất tham gia phản ứng, biết hiệu suất của phản ứng là 75% ? Hoàn thành chuỗi ptpư sau: CaC2→ C2H2 → C2H4→ C2H6 C6H6 → brom benzen LUYỆN TẬP HIĐROCACBON Viết công thức cấu tạo của metan, etilen, axetilen, benzen. Nối chất ở cột A với chất có thể tác dụng được ở cột B và viết ptpư A B Metan Axetilen Etilen Benzen Khí clo (chiếu sáng) Dd brom Brom lỏng (xúc tác bột sắt và đun nóng ) Những hiđrocacbon nào sau đây trong phân tử chỉ có liên kết đơn: A) Etilen B) Benzen C) Metan D) Axetilen Những hiđrocacbon nào sau đây trong phân tử vừa có liên kết đơn vừa có liên kết ba A) Etilen B) Benzen C) Metan D) Axetilen Các chất hiđrocacbon : metan, etilen, axetilen, benzen có tính chất hóa học chung nào: Có thể tác dụng với dd brom C) Có thể tác dụng với khí oxi Có thể tác dụng với khí clo D) Không có tính chất nào chung Viết phương trình hoá học của phản ứng và ghi điều kiện (nếu có) để chứng minh rằng : a) Metan và benzen đều tham gia phản ứng thế. b) Etilen, axetilen và benzen đều tham gia phản ứng cộng. Điều nào dưới đây luôn đúng Các hiđrocacbon đều ở thể khí trong điều kiện thường Đốt cháy bất cứ hiđrocacbon nào cũng đều thu được CO2 và H2O Hợp chất có chứa cacbon trong thành phần phân tử gọi là hợp chất hữu cơ Tất cả đều đúng Khi đốt cháy hoàn toàn một hidrocacbon thu được số mol CO2 và hơi nước bằng nhau. Vậy hidrocacbon đó là: A. CH4 ; B. C2H4 ; C. C2H2 ; D. C6H6 Để tẩy sạch vết dầu mỡ hoặc chất béo dính vào quần áo ta có thể dùng chất nào sau đây: A) Nước B) Dầu hỏa C) Dung dịch nước clo D) Rượu etylic
Tài liệu đính kèm:
 tai_lieu_he_thong_kien_thuc_mon_hoa_hoc_lop_9_phan_huu_co_to.doc
tai_lieu_he_thong_kien_thuc_mon_hoa_hoc_lop_9_phan_huu_co_to.doc



